当前位置:首页 > 中学教育 > 高中教育 > 2016年新课标Ⅱ理综化学高考试题
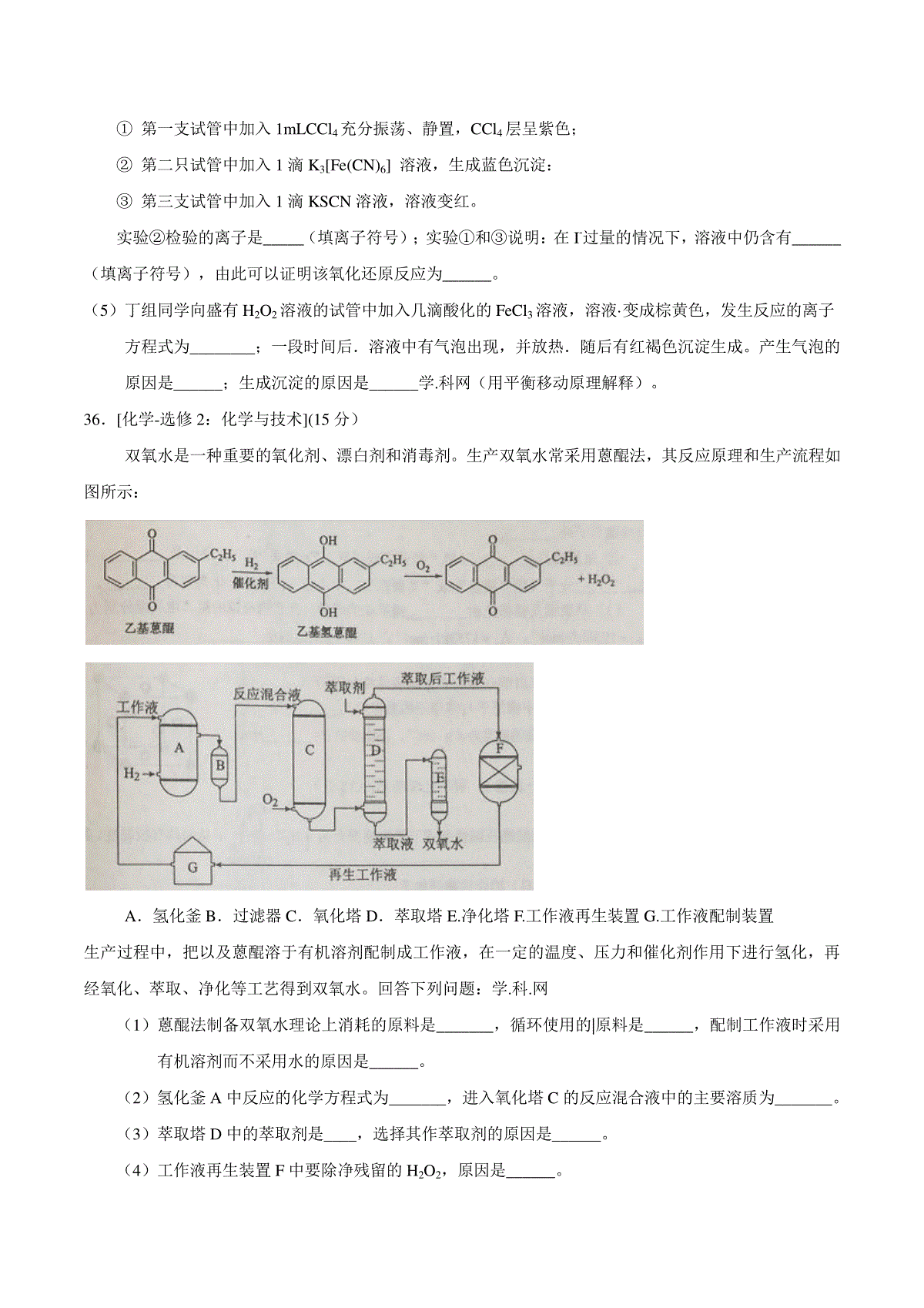
2016年普通高等学校招生全国统一考试理科综合能力测试化学部分7.下列有关燃料的说法错误的是A.燃料燃烧产物CO2是温室气体之一B.化石燃料完全燃烧不会造成大气污染C.以液化石油气代替燃油可减少大气污染D.燃料不完全燃烧排放的CO是大气污染物之一8.下列各组中的物质均能发生加成反应的是A.乙烯和乙醇B.苯和氯乙烯C.乙酸和溴乙烷D.丙烯和丙烷9.a、b、c、d为短周期元素,a的原子中只有1个电子,b2一和c+离子的电子层结构相同,d与b同族。下列叙述错误的是A.a与其他三种元素形成的二元化合物中其化合价均为+1Bb与其他三种元素均可形成至少两种二元化合物cc的原子半径是这些元素中最大的Dd与a形成的化合物的溶液呈弱酸性10.分子式为C4H8Cl2的有机物共有.(不含立体异构)A.7种B.8种C.9种D.10种11.Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是A.负极反应式为Mg—2e-=Mg2+B.正极反应式为Ag++e-=AgC.电池放电时Cl一由正极向负极迁移D.负极会发生副反应Mg+2H2〇=Mg(OH)2+H2↑12.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在.该白色粉末可能为A.NaHCO3、A1(OH)3B.AgCl、NaHCO3C.Na2SO4、BaCO3D.Na2CO3、CuSO413.列实验操作能达到实验目的的是实验目的实验操作A制备Fe(OH)3胶体将NaOH浓溶液滴加到饱和的FeCl3溶液中B由MgCl2溶液制备无水MgCl2将MgCl2溶液加热蒸干C除去Cu粉中混有的CuO加入稀硝酸溶液,过滤、洗涤、干燥D比较水和乙醇中氢的活泼性分别讲少量钠投入到盛有水和乙醇的烧杯中第Ⅱ卷26.联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(1)联氨分子的电子式为_____________,其中氮的化合价为____________。(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。(3)①2O2(g)+N2(g)=N2O4(l)△H1②N2(g)+2H2(g)=N2H4(l)△H2③O2(g)+2H2(g)=2H2O(g)△H3④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048.9kJ/mol上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:N2H4+H+N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为。(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是。27.丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等,回答下列问题:(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:①C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g)△H=-515kJ/mol①C3H6(g)+O2(g)=C3H4O(g)+H2O(g)△H=-353kJ/mol两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是。(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460OC.低于460OC时,丙烯腈的产率(填“是”或者“不是”)对应温度下的平衡产率,判断理由是;高于460OC时,丙烯腈产率降低的可能原因是(双选,填标号)A.催化剂活性降低B.平衡常数变大C.副反应增多D.反应活化能增大(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是。进料氨、空气、丙烯的理论体积约为。28.(15分)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;②第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:③第三支试管中加入1滴KSCN溶液,溶液变红。实验②检验的离子是_____(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______。(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液·变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______学.科网(用平衡移动原理解释)。36.[化学-选修2:化学与技术](15分)双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:A.氢化釜B.过滤器C.氧化塔D.萃取塔E.净化塔F.工作液再生装置G.工作液配制装置生产过程中,把以及蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:学.科.网(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的|原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。(4)工作液再生装置F中要除净残留的H2O2,原因是______。(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。37.[化学--选修3:物质结构与性质](15分)东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:学.科.网(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。①[Ni(NH3)6]SO4中阴离子的立体构型是_____。②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______-,提供孤电子对的成键原子是_____。③氨的沸点(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。学科.网(3)单质铜及镍都是由______键形成的晶体:元素同与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICuINi的原因是______。(4)某镍白铜合金的立方晶胞结构如图所示。①晶胞中铜原子与镍原子的数量比为_____。②若合金的密度为dg/cm3,晶胞参数a=________nm38.[化学--选修5:有机化学基础](15分)氰基丙烯酸酯在碱性条件下能快速聚合为,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:已知:①A的相对分子酯为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰②回答下列问题:(1)A的化学名称为_______。(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。(3)由C生成D的反应类型为________。学科.网(4)由D生成E的化学方程式为___________。(5)G中的官能团有___、____、_____。(填官能团名称)(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2016年新课标Ⅱ理综化学高考试题
链接地址:https://www.777doc.com/doc-7559316 .html