当前位置:首页 > 办公文档 > 工作范文 > 选修4酸碱中和滴定原理
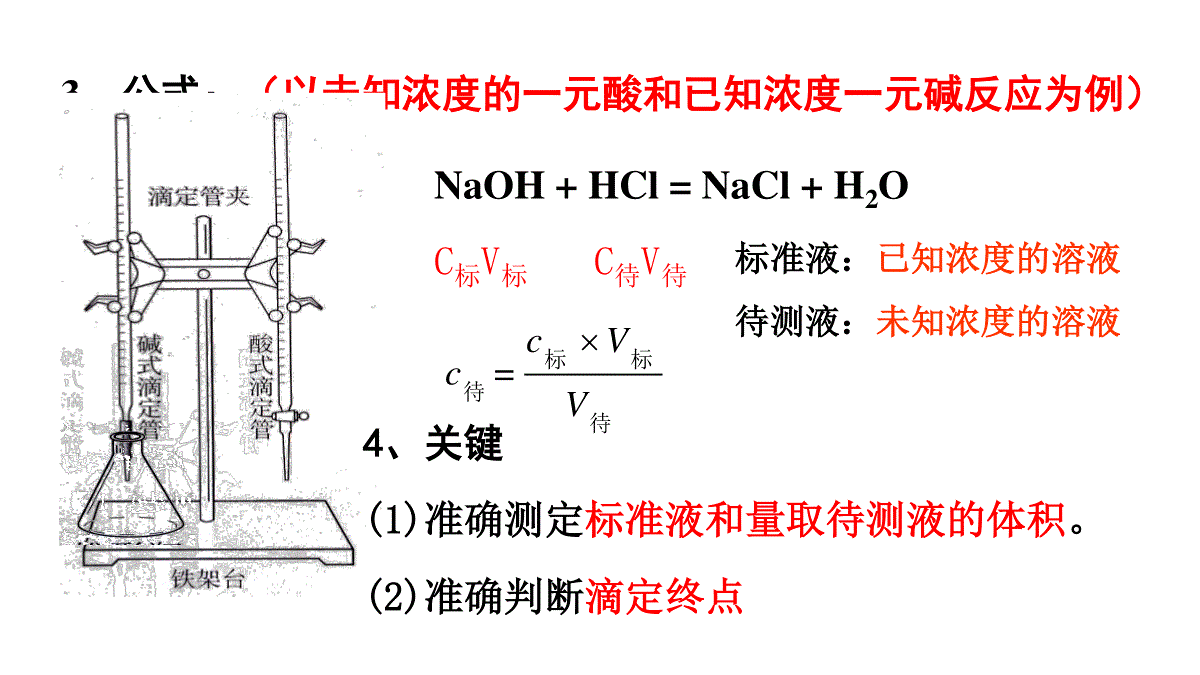
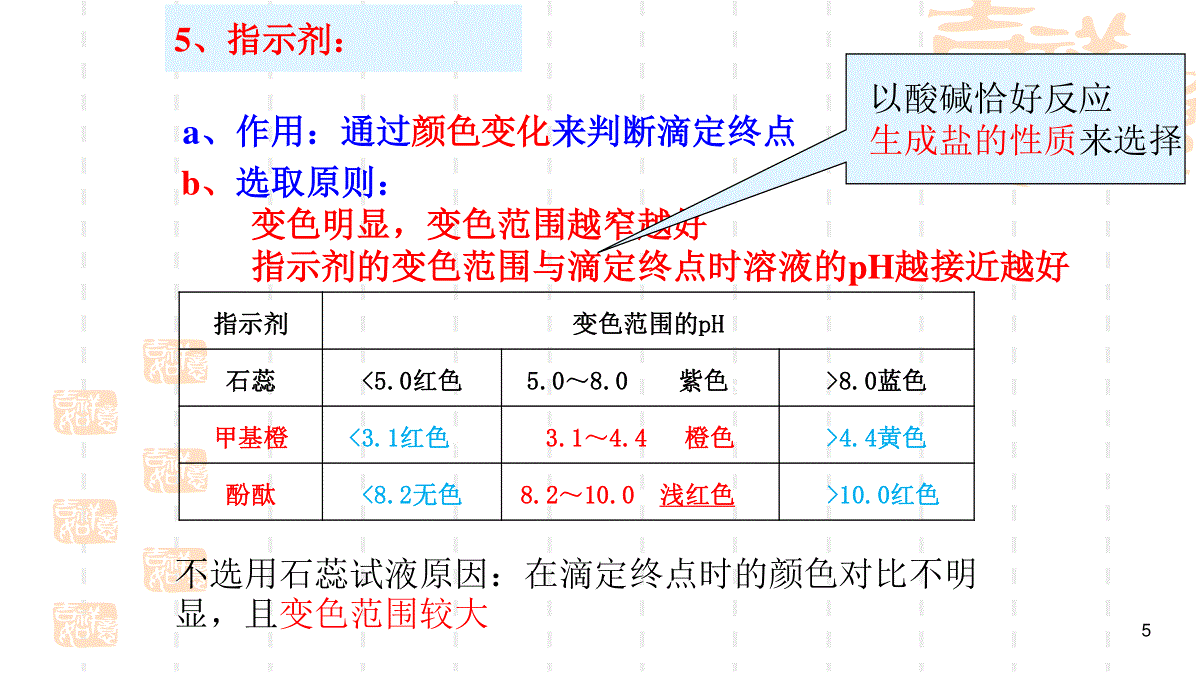
解析:若两溶液完全中和,则溶液中n(H+)=n(OH-),即10-xa=10y-14b,整理得a/b=10x+y-14,①若x+y=12,则a/b=0.01;②若x+y14,则a/b=10x+y-14。过关检测25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,求:①若x+y=12,则a/b=(填数据);②若x+y14,则a/b=(填表达式)。酸碱中和滴定一、酸碱中和滴定基本原理:1、酸碱中和滴定的定义:用已知——————————来测定————————————————————的方法物质的量浓度的酸(或碱)未知物质的量浓度的碱(或酸)2、原理:H++OH-=H2O当完全中和时:n(H+)=n(OH-)CH+V酸=COH-V碱3、公式:(以未知浓度的一元酸和已知浓度一元碱反应为例)=cVcV标标待待标准液:已知浓度的溶液待测液:未知浓度的溶液NaOH+HCl=NaCl+H2OC标V标C待V待4、关键(1)准确测定标准液和量取待测液的体积。(2)准确判断滴定终点5b、选取原则:变色明显,变色范围越窄越好指示剂的变色范围与滴定终点时溶液的pH越接近越好5、指示剂:a、作用:通过颜色变化来判断滴定终点指示剂变色范围的pH石蕊5.0红色5.0~8.0紫色、8.0蓝色甲基橙3.1红色、3.1~4.4橙色4.4黄色酚酞8.2无色8.2~10.0浅红色、10.0红色、不选用石蕊试液原因:在滴定终点时的颜色对比不明显,且变色范围较大以酸碱恰好反应生成盐的性质来选择强酸强碱互滴强酸滴定弱碱强碱滴定弱酸甲基橙或酚酞甲基橙:由黄到橙酚酞:由无色到浅红选择指示剂时,滴定终点前后溶液颜色改变最好由浅到深,颜色变化对比明显指示剂变色范围的pH石蕊5.0红色5.0~8.0紫色、8.0蓝色甲基橙3.1红色、3.1~4.4橙色4.4黄色酚酞8.2无色8.2~10.0浅红色、10.0红色、思考:滴定终点时酸碱恰好完全中和了吗?不一定。滴定终点是指示剂颜色发生变化的点习题演练1.实验室现有3种酸碱指示剂,其pH变色范围如下:D解析:NaOH溶液和CH3COOH溶液恰好完全反应生成CH3COONa显碱性,而酚酞的变色范围为8.2~10.0,比较接近。甲基橙石蕊酚酞3.1~4.45.0~8.08.2~10.0用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是()A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂pH突变和酸碱反应曲线的绘制用20.00mL0.1mol/L的NaOH滴定0.1mol/LHCl后pH的变化V(NaOH)0.0010.0015.0018.0019.0019.9619.98pH11.481.852.282.524.004.30V(NaOH)20.0020.0220.0421.0022.0030.00pH7.009.7010.0011.3911.6812.30c1=0.0999mol/L(19.96mL)c2=0.1002mol/LPH1210864210203040突变范围反应终点加入NaOH(ml)中和滴定曲线酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以极小的误差指示出滴定终点的到达。用20.00mL0.1mol/L的HCl滴定0.1mol/LNaOH后pH的变化V(HCl)0.0010.0015.0018.0019.0019.9619.98pH1312.5212.1511.7211.4110.009.70V(HCl)20.0020.0220.0421.0022.0030.00pH7.004.304.002.612.321.70c1=0.0998mol/Lc2=0.1002mol/L6、滴定终点的判断:加入最后一滴标准液时溶液刚好变色,且半分钟内不褪色7、数据处理:重复做2--3次,取几次标准液体积的平均值计算注意:数据误差较大时应舍去=cVcV标标待待一元酸和一元碱为例数据记录:滴定次数实验数据(mL)1234V(样品)20.0020.0020.0020.00V(NaOH)(消耗)15.9515.0015.0514.95易错易混中和滴定的两个易错点(1)分清酸碱完全中和与溶液恰好为中性①完全中和强调的是酸、碱恰好反应生成盐,根据酸碱的强弱不同,溶液可能为中性,也可能为酸性或碱性。②酸碱反应恰好为中性则强调的是反应后溶液为中性,而酸、碱不一定正好反应。可能酸不足,也可能酸过量,也可能恰好反应。这取决于酸碱的相对强弱。4.计算25℃时,下列溶液的pH。(1)0.005mol·L-1的H2SO4溶液;(2)0.005mol·L-1的Ba(OH)2溶液;(3)0.1mol·L-1的HA溶液[Ka(HA)=1×10-5];(4)0.1mol·L-1的MOH溶液(有1%的MOH已电离)。(2)c(OH-)=0.005mol·L-1×2=0.01mol·L-1,c(H+)=141100.01mol·L-1=1×10-12mol·L-1,pH=12。解析:(1)c(H+)=0.005mol·L-1×2=0.01mol·L-1,pH=2。(3)设溶液中的c(H+)=xmol·L-1,由HAH++A-0.1-xxx知20.1xx=1×10-5,由于Ka(HA)很小,则0.1-x≈0.1,故x=1×10-3,即pH=3。解析:(4)c(OH-)=0.1mol·L-1×1%=1×10-3mol·L-1,c(H+)=143110110mol·L-1=1×10-11mol·L-1,即pH=11。


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:选修4酸碱中和滴定原理
链接地址:https://www.777doc.com/doc-1847272 .html