当前位置:首页 > 中学教育 > 高中教育 > 高考化学复习单元测试(2)—碱金属
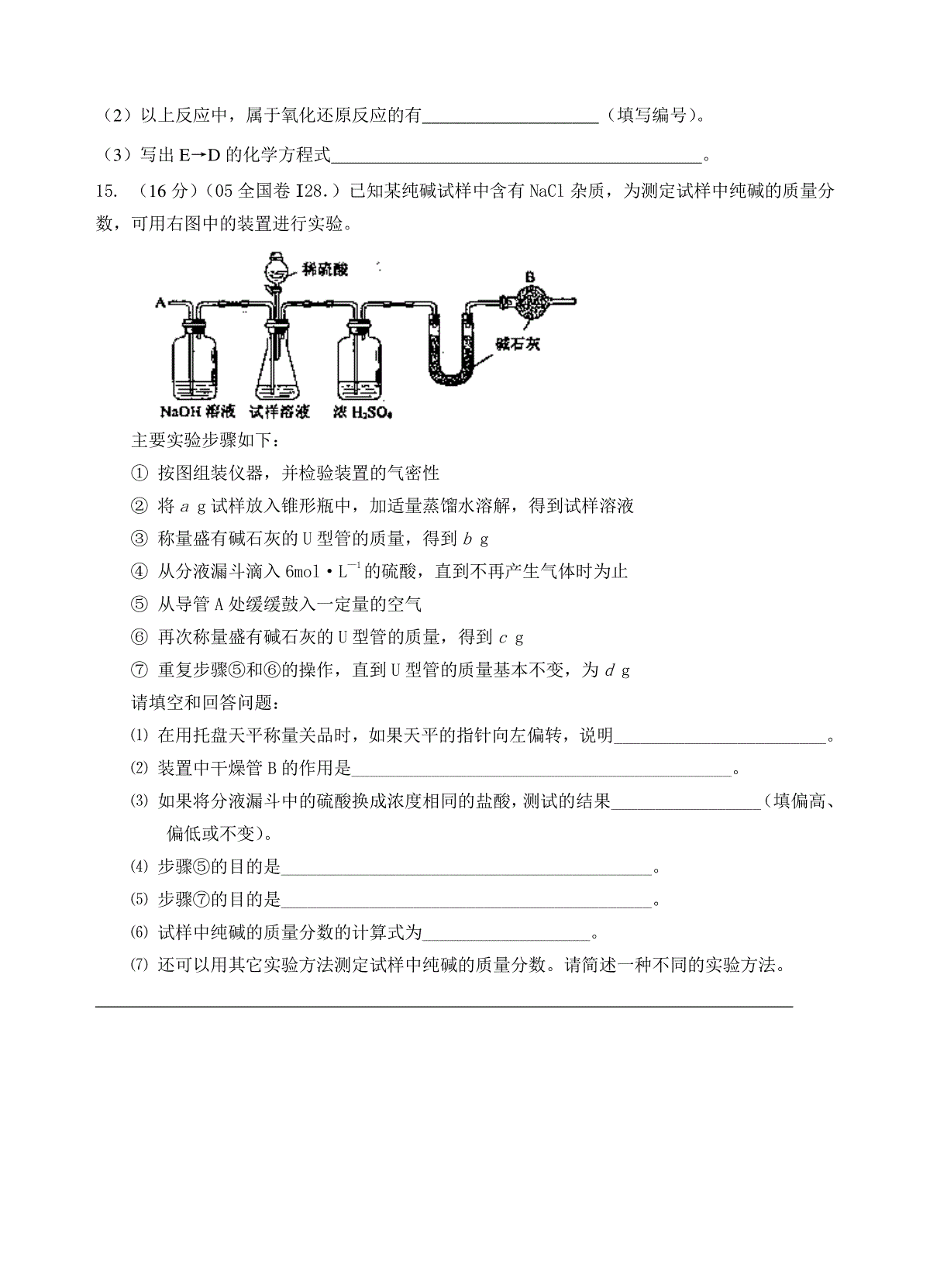
高三化学复习单元测试(2)—碱金属本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量:H:1C:12O:16S:32N:14Cu:64Fe:56Ag:108第Ⅰ卷(选择题,共48分)一、选择题(每小题只有一个选项符合题意,每小题4分,共12题)1.(05江苏9.)下列有关钠的叙述中,错误的是A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界C.钠是一种灰黑色的固体D.钠的质地软,可用小刀切割2.金属钠在空气中长久放置,最终生成物是A.Na2O2B.Na2OC.Na2CO3D.NaOH3.将ag金属钠投入到bg水中(水过量),反应后所得溶液的质量分数是A.a/(a+b)100%B.40a/(a+b)100%C.20a/(a+b)100%D.40a/(22a+23b)100%4.等质量的Na2CO3、NaHCO3与足量盐酸作用,符合下列情况的是A.Na2CO3比NaHCO3反应速率快B.相同条件下Na2CO3产生的CO2体积大C.NaHCO3比Na2CO3反应剧烈D.两者放出CO2的体积一样5.为确证NaHCO3固体中是否含Na2CO3,下列实验操作及判断正确的是A.观察加热时能否放出气体B.观察加盐酸时能否放出气体C.溶于水中,加入澄清石灰水,观察是否有白色沉淀生成D.溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成6.下列反应的离子方程式书写正确的是A.碳酸钠溶液跟盐酸混合CO32-+2H+==CO2↑+H2OB.碳酸氢钠溶液跟石灰水混合HCO3-+OH-=CO32-+H2OC.碳酸氢钠溶液跟氢氧化钠溶液混合H++OH-=H2OD.金属钠投入水中Na+H2O=Na++OH-+H2↑7.在稀溶液中下列离子能共存,且加人NaOH溶液有沉淀析出,加人盐酸有气体逸出的一组是A.Na+、SO42-、Cu2+、Cl-B.Na+、Ca2+、Cl-、HCO3-C.K+、Na+、NO3-、CO32-D.Ca2+、K+、SO42-、CO32-8.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液的体积无变化)A.CH3COO-B.SO32-C.CO32-D.HCO3-9.下列物质能使品红溶液褪色的是①活性炭②过氧化钠③氯水④SO2⑤臭氧A.①③④B.②④⑤C.①②③④D.①②③④⑤10.在天平两托盘上分别放上质量相等的两只烧杯,在杯中分别加入等物质的量浓度、等体积的硫酸,些时天平处于平衡状态,然后分别向两只烧杯中加入等质量的无水碳酸钠和碳酸氢钠,最后天平两端的相对质量是A.放NaHCO3的一端质量大B.放Na2CO3的一端质量大C.天平仍处于平衡状态D.无法判断11.向含0.14molNa2CO3的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是A.得0.2molNaCl和0.08molNaHCO3B.剩0.04molNa2CO3,得0.20molNaClC.剩0.06molHCl,得0.14molNaCl和0.14molNaHCO3D.得0.06molNaCl和0.08molNaHCO312.碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为A.3.38gB.4.58gC.4.16gD.4.41g第I卷答题表班考号姓名第Ⅱ卷(非选择题共60分)13.(10分)往碳酸氢钠稀溶液中滴入氯化钙溶液,无沉淀产生,其原因是;若往上述混合溶液中加入氢氧化钠溶液,可观察到,其离子方程试为;在0.5mol·L:纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是:___________________________________________________14.(10分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。请填写下列空白:(1)写出化学式:A________________,B________________,D________________。题号123456789101112答案(2)以上反应中,属于氧化还原反应的有____________________(填写编号)。(3)写出E→D的化学方程式。15.(16分)(05全国卷I28.)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。主要实验步骤如下:①按图组装仪器,并检验装置的气密性②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液③称量盛有碱石灰的U型管的质量,得到bg④从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止⑤从导管A处缓缓鼓入一定量的空气⑥再次称量盛有碱石灰的U型管的质量,得到cg⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg请填空和回答问题:⑴在用托盘天平称量关品时,如果天平的指针向左偏转,说明________________________。⑵装置中干燥管B的作用是___________________________________________。⑶如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________(填偏高、偏低或不变)。⑷步骤⑤的目的是__________________________________________。⑸步骤⑦的目的是__________________________________________。⑹试样中纯碱的质量分数的计算式为___________________。⑺还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。16.(12分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是,其物质的量之比是,产生的CO2气体体积(标况)是。乙所得溶液中存在的溶质是其物质的量之比是,产生的CO2气体体积(标况)是。17.(本题共12分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。(1)称取0.542g过氧化钙样品,灼热时发生如下反应:2CaO2·XH2O→△2CaO+O2↑+2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为。(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO30.70g。①试计算样品中CaO的质量。②试计算样品中CaO2·XH2O的X值。甲7550VCO2VHCl/mL257550VCO2VHCl/mL25乙高三化学复习单元测试(2)碱金属—参考答案第Ⅰ卷(选择题,共48分)第Ⅱ卷(非选择题共60分)13.Ca(HCO3)2可溶于水,有白色沉淀产生,Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O;产生白色沉淀,且溶液的红色褪去,14.(1)NaNa2O2Na2CO3(2)①②③④(3)2NaHCO3Na2CO3+CO2↑+H2O15.(1)样品重,砝码轻(2)防止空气中的CO2和水气进入U型管中(3)偏高(4)把反应中的CO2全部导入U型管中(5)判断反应中的CO2是否全部排出,并被U型管中的碱石灰吸收(6)a44b)-d106(×100%(7)取一定量的纯碱试样,溶入适量的蒸馏水中,加入足量的BaCl2溶液,过滤、洗涤、干燥、称量滤渣(BaCO3)(或其它合理答案)16.解析:NaOH溶液中通入一定量的CO2,有几种情况:一种情况是CO2不足,反应后的混合物为NaOH,Na2CO3;另一种情况是二者恰好完全反应生成Na2CO3;第三种情况是CO2过量,全部NaOH转化为NaHCO3;第四种情况是CO2过量,反应后的混合物为NaHCO3和Na2CO3。分析甲图象:加入盐酸50mL时开始产生CO2气体,至反应完毕消耗25mL盐酸,根据反应:Na2CO3+HCl=NaHCO3+NaCl①NaHCO3+HCl=NaCl+H2O+CO2↑②可知滴加到50mL时开始反应②,根据耗酸量可知NaHCO3的物质的量。分析图象加入50mL以前,无气体放出,与盐酸反应转化为NaHCO3应消耗25mL盐酸,则与NaOH反应的盐酸也应是25mL。由此得也甲成分只能为NaOH和Na2CO3,且物质的量之比为1:1,产生CO2的体积为0.056L.分析乙图象:加入盐酸25mL时开始产生CO2气体,消耗50mL盐酸反应完全,耗酸为末产生气体时的2倍,说明原物质是Na2CO3和NaHCO3的混合物,由耗酸量可判断出物质之比为1:1,产生气体亦可由产生气体耗酸量求得,为0.112L。17.(1)0.006mol(2)①n(CaO2)=0.006moln(Ca2+)=0.007molm(CaO)=0.056g②n(H2O)=0.003molX=1/2题号123456789101112答案CCDCDABADBAC




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高考化学复习单元测试(2)—碱金属
链接地址:https://www.777doc.com/doc-7433054 .html