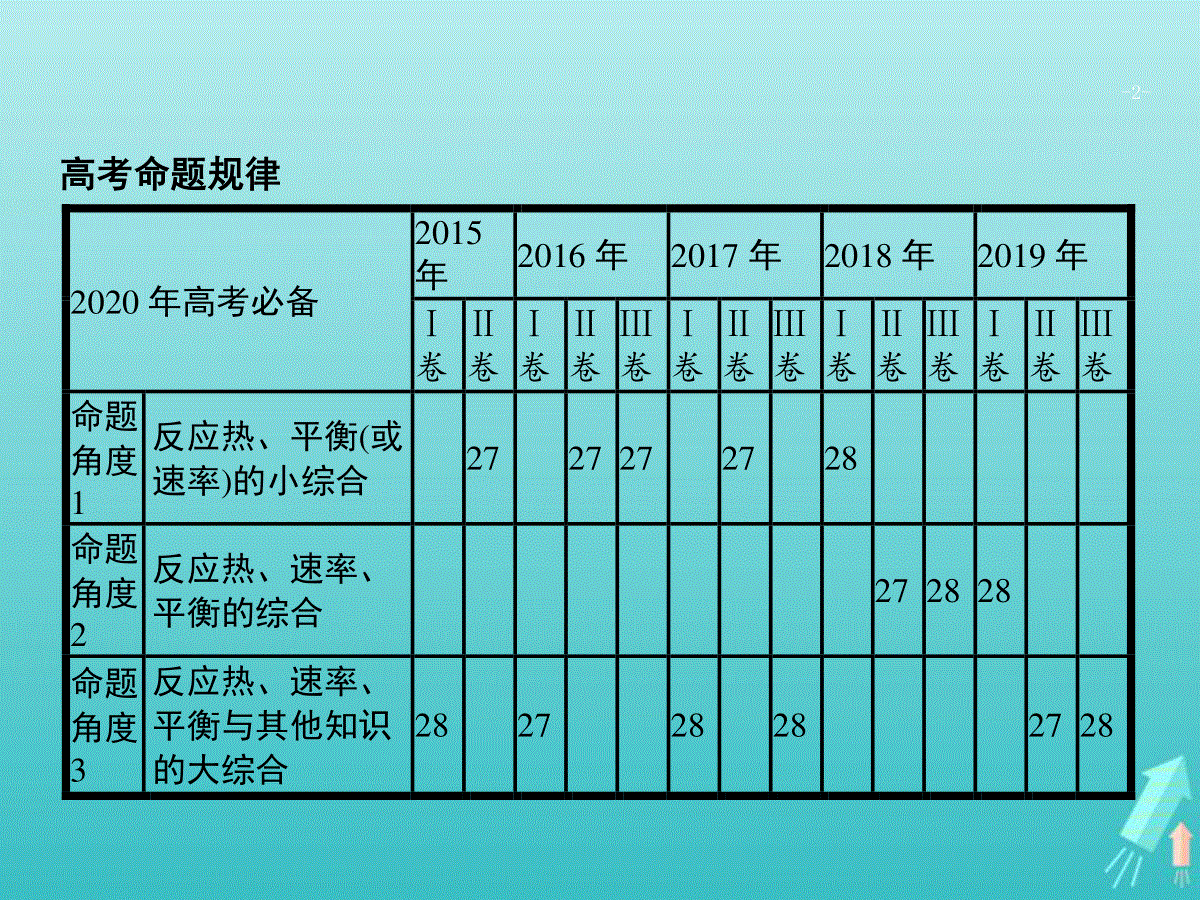
题型九化学反应中能量变化、反应速率和化学平衡的综合题-2-高考命题规律2020年高考必备2015年2016年2017年2018年2019年Ⅰ卷Ⅱ卷Ⅰ卷Ⅱ卷Ⅲ卷Ⅰ卷Ⅱ卷Ⅲ卷Ⅰ卷Ⅱ卷Ⅲ卷Ⅰ卷Ⅱ卷Ⅲ卷命题角度1反应热、平衡(或速率)的小综合2727272728命题角度2反应热、速率、平衡的综合272828命题角度3反应热、速率、平衡与其他知识的大综合282728282728-3-高考真题体验典题演练提能反应热、平衡(或速率)的小综合1.(2018全国Ⅰ,28)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为。(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:2N2O5(g)4NO2(g)+O2(g)2N2O4(g)其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,N2O5(g)完全分解]:-4-高考真题体验典题演练提能③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)63.1kPa(填“大于”“等于”或“小于”),原因是。④25℃时N2O4(g)2NO2(g)反应的平衡常数Kp=kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。t/min0408016026013001700∞p/kPa35.840.342.545.949.261.262.363.1①已知:2N2O5(g)2N2O4(g)+O2(g)ΔH1=-4.4kJ·mol-12NO2(g)N2O4(g)ΔH2=-55.3kJ·mol-1则反应N2O5(g)2NO2(g)+12O2(g)的ΔH=kJ·mol-1。②研究表明,N2O5(g)分解的反应速率v=2×10-3×𝑝N2O5(kPa·min-1),t=62min时,测得体系中𝑝O2=2.9kPa,则此时的𝑝N2O5=kPa,v=kPa·min-1。-5-高考真题体验典题演练提能(3)对于反应2N2O5(g)4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:第一步N2O5NO2+NO3快速平衡第二步NO2+NO3NO+NO2+O2慢反应第三步NO+NO32NO2快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是(填标号)。A.v(第一步的逆反应)v(第二步反应)B.反应的中间产物只有NO3C.第二步中NO2与NO3的碰撞仅部分有效D.第三步反应活化能较高-6-高考真题体验典题演练提能答案:(1)O2(2)①53.1②30.06.0×10-2③大于温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高④13.4(3)AC解析:(1)干燥的氯气与干燥的AgNO3之间发生氧化还原反应时,氯气作氧化剂,而AgNO3中Ag、N元素都处于最高价,所以被氧化的只能为氧元素,则得到的气体为氧气。-7-高考真题体验典题演练提能(2)①由盖斯定律可知,(第一个已知反应÷2)-(第二个已知反应)可得反应:N2O5(g)2NO2(g)+12O2(g),则该反应的ΔH=-4.4kJ·mol-1÷2-(-55.3kJ·mol-1)=+53.1kJ·mol-1。②依据反应:N2O5(g)2NO2(g)+12O2(g)及气体的物质的量与其形成的压强成正比,生成的O2的压强p(O2)=2.9kPa,则剩余N2O5形成的压强p(N2O5)=35.8kPa-2.9kPa×2=30.0kPa。则N2O5的分解速率v=2×10-3×30.0kPa·min-1=6.0×10-2kPa·min-1。③若提高反应温度至35℃,由于体积不变,但温度提高,总压强增大,且2NO2(g)N2O4(g)ΔH2=-55.3kJ·mol-1为放热反应,温度升高,平衡左移,气体的物质的量增大,总压强提高,所以N2O5完全分解后体系压强p∞大于63.1kPa。④当t=∞时,体系的总压强为63.1kPa为平衡时的总压强,此时N2O5完全分解,生成的氧气的压强为:p(O2)=35.8kPa2=17.9kPa。若NO2不生成N2O4,则此时的总压应为35.8kPa×52=89.5kPa,而实际压强为63.1kPa,压强差为:89.5kPa-63.1kPa=26.4kPa-8-高考真题体验典题演练提能2NO2N2O4压强差21126.4kPa26.4kPa则平衡时NO2的分压为63.1kPa-p(O2)-p(N2O4)=18.8kPa由此可求反应N2O4(g)2NO2(g)的平衡常数为(18.8kPa)226.4kPa≈13.4kPa。(3)根据第一步能“快速平衡”及第二步“慢反应”可判断A项正确;反应的中间产物有NO3及NO,B项错误;根据第二步反应:NO2+NO3NO+NO2+O2可知,部分NO2没有参加反应,C项正确;第三步为“快反应”,则该步反应的活化能较低,D项错误。-9-高考真题体验典题演练提能2.(2017全国Ⅱ,27)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:①C4H10(g)C4H8(g)+H2(g)ΔH1已知:②C4H10(g)+12O2(g)C4H8(g)+H2O(g)ΔH2=-119kJ·mol-1③H2(g)+12O2(g)H2O(g)ΔH3=-242kJ·mol-1反应①的ΔH1为kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。A.升高温度B.降低温度C.增大压强D.降低压强-10-高考真题体验典题演练提能(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是。-11-高考真题体验典题演练提能(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。答案:(1)+123小于AD(2)原料中过量H2会使反应①平衡逆向移动,所以丁烯转化率下降(3)590℃前升高温度,反应①平衡正向移动升高温度时,反应速率加快,单位时间产生丁烯更多更高温度导致C4H10裂解生成更多的短碳链烃,故丁烯产率快速降低-12-高考真题体验典题演练提能解析:(1)根据盖斯定律,②式-③式可得①式,因此ΔH1=ΔH2-ΔH3=-119kJ·mol-1+242kJ·mol-1=+123kJ·mol-1。由图(a)可以看出,温度相同时,由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,由于反应①是气体物质的量增大的反应,压强越小平衡转化率越大,所以x的压强更小,x0.1。由于反应①为吸热反应,所以温度升高时,平衡正向移动,丁烯的平衡产率增大,因此A正确,B错误。由于反应①是气体物质的量增大的反应,加压时平衡逆向移动,丁烯的平衡产率减小,因此C错误,D正确。(3)590℃之前,随温度升高,反应速率增大,反应①是吸热反应,升高温度平衡正向移动,生成的丁烯会更多。温度超过590℃,更多的丁烷裂解生成短链烃类,导致丁烯产率快速降低。(2)H2是反应①的产物,增大𝑛(氢气)𝑛(丁烷)会促使平衡逆向移动,从而降低丁烯的产率。-13-高考真题体验典题演练提能3.(2016全国Ⅱ,27)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等。回答下列问题:(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是。①C3H6(g)+NH3(g)+32O2(g)C3H3N(g)+3H2O(g)ΔH=-515kJ·mol-1②C3H6(g)+O2(g)C3H4O(g)+H2O(g)ΔH=-353kJ·mol-1-14-高考真题体验典题演练提能(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。低于460℃时,丙烯腈的产率(填“是”或“不是”)对应温度下的平衡产率,判断理由是;高于460℃时,丙烯腈产率降低的可能原因是(双选,填标号)。A.催化剂活性降低B.平衡常数变大C.副反应增多D.反应活化能增大图(a)图(b)-15-高考真题体验典题演练提能(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是。进料气氨、空气、丙烯的理论体积比约为。答案:(1)两个反应均为放热量大的反应降低温度、降低压强催化剂(2)不是该反应为放热反应,平衡产率应随温度升高而降低AC(3)1.0该比例下丙烯腈产率最高,而副产物丙烯醛产率最低1∶7.5∶1解析:(1)从反应的焓变可看出这两个反应都为放热反应,且“1mol反应”放出的热量大,故两个反应在热力学上的趋势很大。由于生成丙烯腈的反应为气体体积增大的放热反应,故要提高丙烯腈的产率可采取的措施为降温、降压。提高丙烯腈反应选择性的关键因素是使用合适的催化剂。-16-高考真题体验典题演练提能(2)图(a)中,低于460℃时的曲线不表示丙烯腈的产率,因为合成丙烯腈的反应为放热反应,温度降低时,丙烯腈的产率应增大,而非减小。高于460℃时,丙烯腈产率降低的原因分析:催化剂活性降低,合成丙烯腈的反应速率减小,而副反应可能更多地发生,A项符合题意;平衡常数增大,丙烯腈的产率增大,B项不符合题意;副反应增多,可能导致丙烯腈产率降低,C项符合题意;反应活化能增大,并不影响平衡的移动,不会导致丙烯腈的产率变化,D项不符合题意。(3)由图(b)可知,当n(氨)/n(丙烯)在1.0左右时丙烯腈的产率达最大值,而副产物丙烯醛的产率达最小值。由反应①知,V(NH3)∶V(O2)∶V(C3H6)=2∶3∶2,而V(O2)∶V(空气)≈1∶5,则进料气的理论体积比约为V(NH3)∶V(空气)∶V(C3H6)=2∶15∶2,即1∶7.5∶1。-17-高考真题体验典题演练提能4.(2016全国Ⅲ,27)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:(1)NaClO2的化学名称为。(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。离子SO42-SO32-NO3-NO2-Cl-c/(mol·L-1)8.35×10-46.87×10-61.5×10-41.2×10-53.4×10-3-18-高考真题体验典题演练提能①写出NaClO2溶液脱硝过程中主要反应的离子方程式。增加压强,NO的转化率(填“提高”“不变”或“降低”)。②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”“不变”或“减小”)。③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是。-19-高考真题体验典题演练提能(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”“不变”或“减小”)。②反应ClO2-+2SO32-2SO42-+Cl-的平衡常数K表达式为。-20-高考真题体验典题演练




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:2020版高考化学二轮复习 题型九 化学反应中能量变化、反应速率和化学平衡的综合题课件
链接地址:https://www.777doc.com/doc-8106706 .html