当前位置:首页 > 临时分类 > 高中化学必修1离子反应
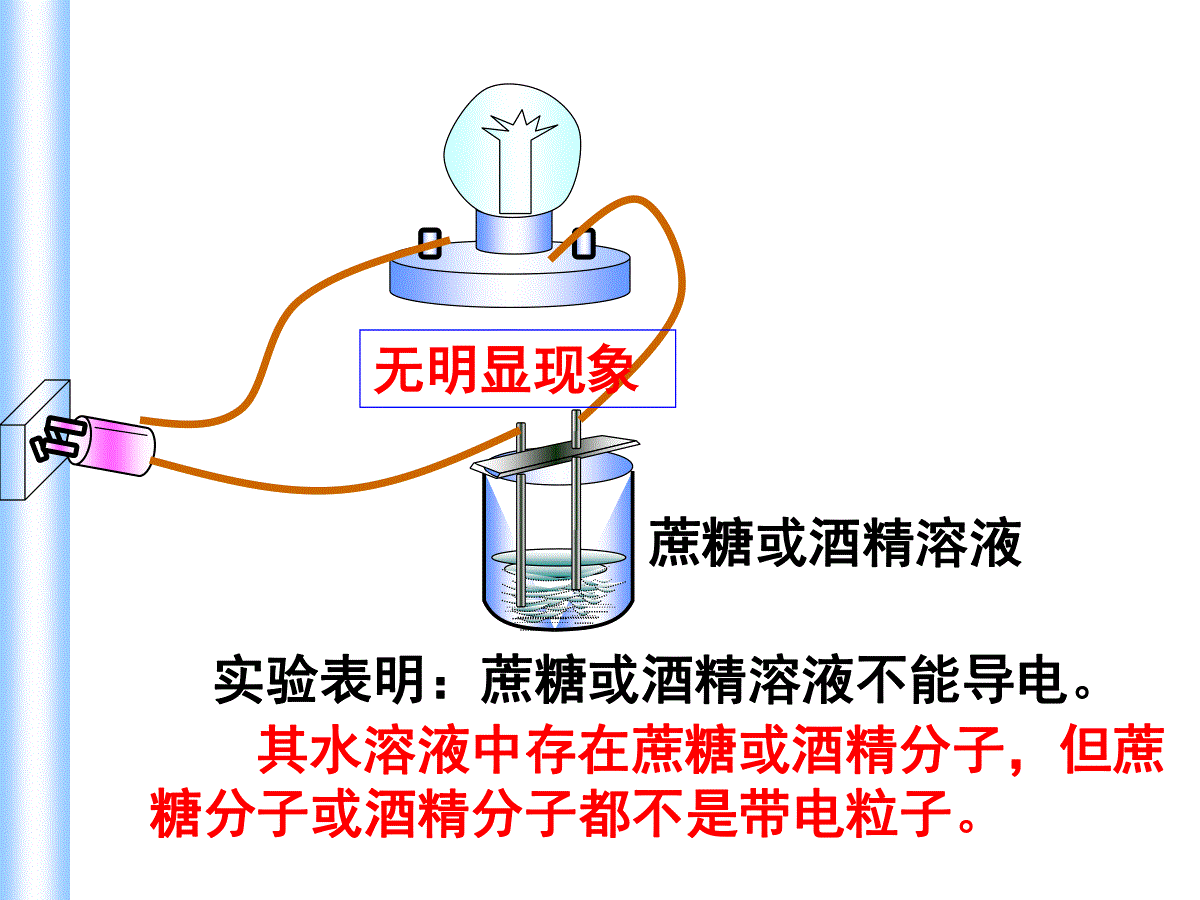
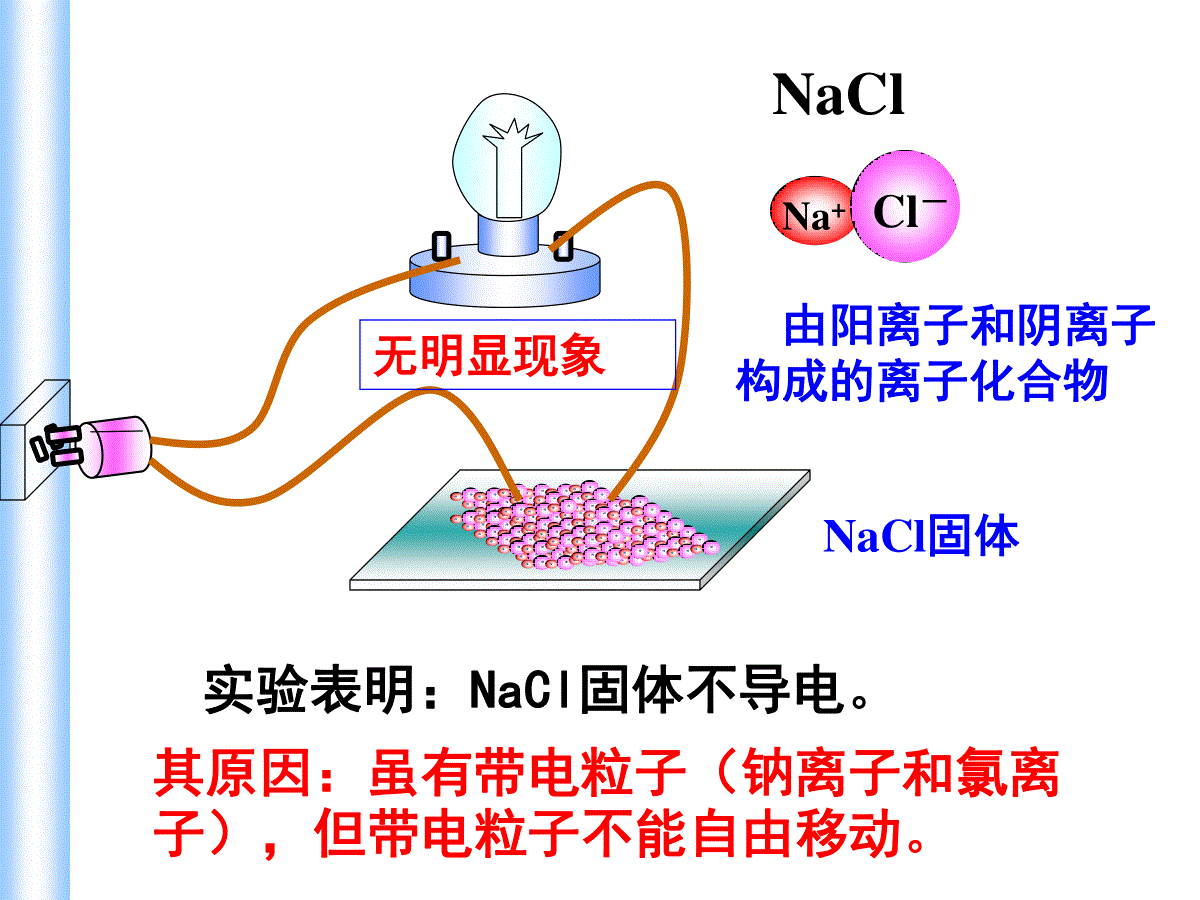
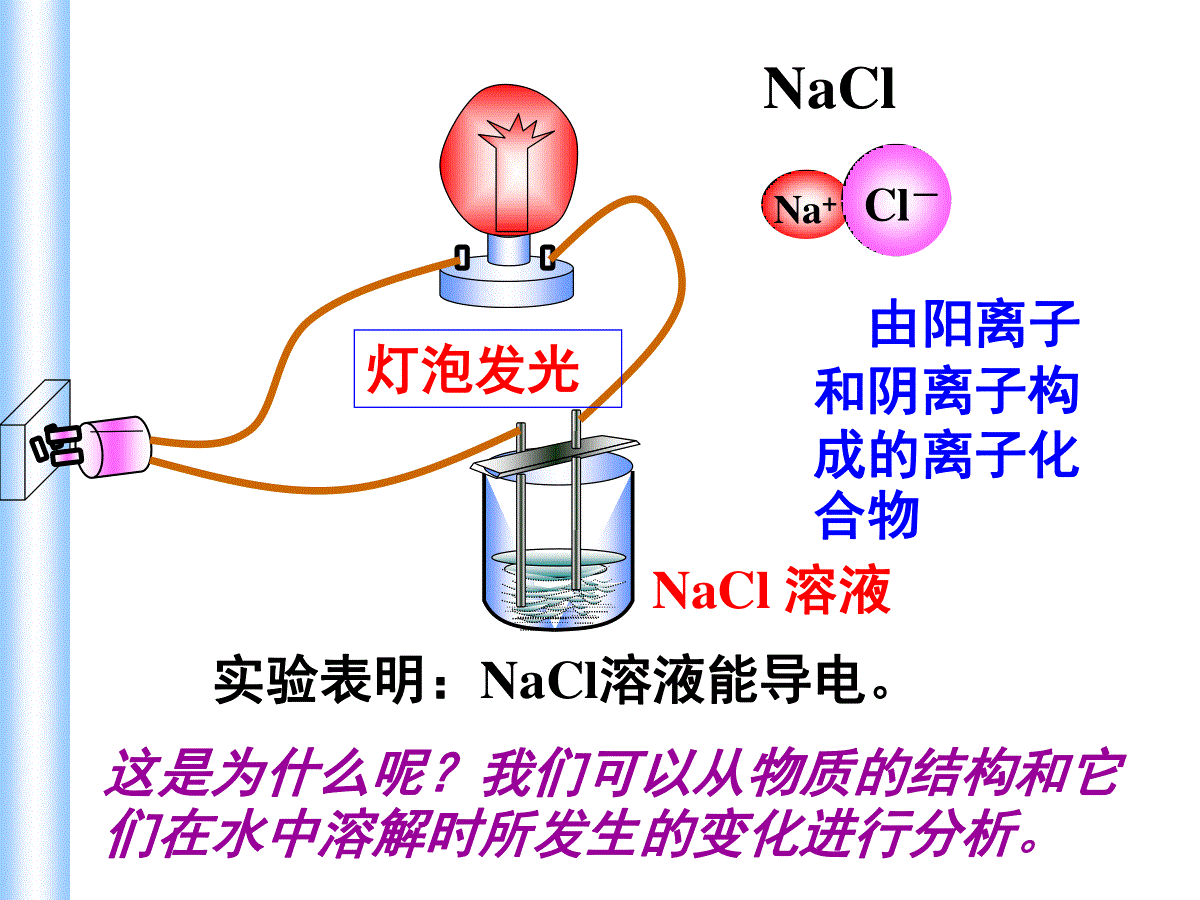
铜线实验表明:金属(铜、铁)能导电金属能导电的原因是什么?金属能产生自由移动的带电粒子(电子)灯泡发光蔗糖或酒精溶液实验表明:蔗糖或酒精溶液不能导电。其水溶液中存在蔗糖或酒精分子,但蔗糖分子或酒精分子都不是带电粒子。无明显现象NaClNa+Cl-NaCl固体由阳离子和阴离子构成的离子化合物实验表明:NaCl固体不导电。其原因:虽有带电粒子(钠离子和氯离子),但带电粒子不能自由移动。无明显现象NaCl溶液实验表明:NaCl溶液能导电。这是为什么呢?我们可以从物质的结构和它们在水中溶解时所发生的变化进行分析。NaClNa+Cl-由阳离子和阴离子构成的离子化合物灯泡发光NaCl加入水中Na+Cl-NaClH2O水分子与NaCl晶体作用NaCl溶解并电离哪些物质可以导电?为什么可以导电?分别属于哪种变化?温度变化对导电性的影响如何?铜、铁、铝、银等金属;碳棒,石墨非金属;还有盐酸、硫酸、氢氧化钠,氯化钠、硫酸铜等溶液都能导电.物质能导电的条件是:有能够自由移动的电子或离子1、电解质与非电解质(1)电解质:在水溶液里或熔融状态下能导电的化合物,叫做电解质。(2)非电解质:在水溶液里或熔融状态下都不能导电的化合物,叫做非电解质。(包括:酸、碱、盐、和活泼金属氧化物)(包括:大多数有机化合物和非金属氧化物。如酒精,蔗糖,甲烷NH3,CO,CO2,SO2、SO3,NO2,NO,P2O5等)一、酸碱盐在水溶液中的电离(3)判断电解质与非电解质注意的问题①电解质和非电解质都是对化合物言.单质和混合物不是电解质也不是非电解质。②不是所有的电解质的水溶液都能导电.如BaSO4、CaCO3、AgCl等在水中的溶解度很小,它们的水溶液几乎不导电,但是它们在熔融状态下能电离出离子,能够导电导电,所以它们是电解质③化合物在熔化或溶解于水时能否导电,是判断其是否是电解质的依据。如NH3、SO2溶于水均能导电,是电解质吗?并不是它们本身能电离出自由离子,而是它们与H2O反应的生成物NH3·H2O、H2SO3电离出离子而导电,所以NH3和SO2都不是电解质。只能说NH3·H2O、H2SO3是电解质.电解质与电解质溶液的区别:前者为化合物,本身不导电;后者为混合物,能导电•存在自由移动的阴阳离子就是电解质导电的原因。•离子浓度的大小和所带电荷的高低是决定导电能力大小的因素。2.电解质溶液导电的原因及导电能力电离:电解质溶于水或受热时,离解出自由移动的阴阳离子的过程。溶液的导电性溶液导电示意图定向运动自由移动的离子电解质溶液电离外电场导电1、下列物质哪些是电解质?①盐酸溶液;②NaCl固体;③HCl气体;④二氧化硫水溶液;⑤BaSO4;⑥纯醋酸;⑦NaOH溶液;⑧铝;⑨纯酒精。能导电:电解质:非电解质:①、④、⑦、⑧②、③、⑤、⑥⑨2、下列物质属于非电解质的是()A、液态汞B、液态氨C、硫酸钡D、硝酸3、下列物质的水溶液能导电,但属于非电解质的是()A、CH3COOHB、H2SO4C、Cl2D、SO24、下列叙述正确的是()A.固体氯化钠不导电,所以氯化钠是非电解质B.铜丝能导电,所以铜是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.五氧化二磷溶于水能导电,所以五氧化二磷是电解质BDC判断正误:(1)铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质(2)液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质(3)硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质(4)把SO3溶于水所得的溶液能导电,所以SO3是电解质.XXXX(5)BaSO4难溶于水所以BaSO4是非电解质(6)电解质都能够导电,能导电的物质都是电解质(7)电解质在水溶液中和熔融状态下都能导电(8)化合物不是电解质就是非电解质.(9)氧化钙溶于水能导电,所以它是电解质(10)固体氯化钠不导电,所以它不是电解质物质能否导电并不是判断是否属于电解质的根据,要根据在水溶液或熔融状态下能否电离进行判断!XXXXX强电解质:在水溶液里几乎完全电离的电解质弱电解质:在水溶液里只有部分电离的电解质3、强弱电解质强酸、强碱、大部分的盐类弱酸、弱碱、水①、强电解质:在水溶液中全部电离(指溶解的部分)的电解质;溶液中只存在溶质离子,不存在溶质分子.与溶解度无关②、弱电解质:水溶液中既存在溶质离子,又存在溶质分子少多③、电解质溶液的导电能力与电解质的强弱没有关系。同温,同种溶质的饱和溶液比不饱和溶液导电性强;注意下列物质中,属于弱电解质的是(),属于非电解质的是()①氨气②氨水③硫酸钡④氯气⑤醋酸铵⑥铜⑦水⑧酒精⑦⑨①⑧4、强电解质的电离方程式(2)书写步骤:①、阴阳离子拆开写,但原子团不能拆,例如NO3-、SO42-、OH-、NH4+、CO32-等②、构成物质的原子或原子团的个数在书写成离子时为系数.(1)定义:表示电解质电离的式子叫电离方程式,简称电离式NaCl=Na++Cl-Al2(SO4)3=2Al3++3SO42-(3)书写注意事项:①式子左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。②离子所带的电荷数应等于元素或原子团的化合价数。③在电解质溶液中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数。请写出下列三组物质的电离方程式。第一组:HCl、H2SO4、HNO3;第二组:Ba(OH)2、NaOH;第三组:NaCl、K2SO4电离时生成的阳离子全部是H+的化合物叫做酸电离时生成的阴离子全部是OH-的化合物叫做碱电离时能生成金属阳离子(包括NH4+)和酸根离子的化合物叫做盐HCl=H++Cl-H2SO4=2H++SO42-HNO3=H++NO3-Ba(OH)2=Ba2++2OH-NaOH=Na++OH-NaCl=Na++Cl-K2SO4=2K++SO42-电离时生成的阳离子全部是H+的化合物叫做酸练习2:写出下列电解质的电离方程式:Ca(NO3)2=Ca2++2NO3—NaHSO4=Na++H++SO42—NaHCO3=Na++HCO3—Ca(NO3)2NaHSO4NaHCO3BaSO4BaSO4=Ba2++SO42—5、酸、碱、盐的定义酸:电离时生成的阳离子全部是H+的化合物叫做酸。如:HCl、H2SO4、HNO3、HF、HBr、CH3COOH等碱:电离时生成的阴离子全部是OH-的化合物叫做碱。如:Ba(OH)2、NaOHKOH、Ca(OH)2、NH3.H2O等盐:电离时能生成金属阳离子(包括NH4+)和酸根离子的化合物叫做盐.如NaCl,K2SO4,Mg(NO3)2,CH3COONa等探究1.Ba(OH)2和H2SO4反应1.描述实验现象,写出化学反应方程式、电离方程式实验内容反应前溶液中大量存在的离子反应后溶液中大量存在的离子实际发生反应的离子反应后溶液中离子浓度的变化2.试根据表分析溶液中离子浓度变化。3.溶液导电性变化的原因是:_______________探究1.Ba(OH)2和H2SO4反应Ba2+OH-H+SO42-无降低Ba2+OH-H+SO42-H2SO4溶液2mlBa(OH)2溶液4.Ba(OH)2溶液和H2SO4溶液反应的实质是什么?Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2OBa2++SO42-=BaSO4↓BaCl2溶液与CuSO4溶液反应的实质是?Ba2+、Cl-Cu2+、SO42-沉淀的生成导致溶液中Ba2+和SO42-的浓度减小同理:请判断下列反应是否属于离子反应。1、2H2+O2=2H2O2、2Na+2H2O=2NaOH+H2↑3、HCl+NaOH=NaCl+H2O有离子参加无离子参加或生成有离子生成有离子参加或生成的反应。1、离子反应:二、离子反应及其发生的条件实验内容现象反应后离子数目的变化反应的本质实验1:实验2:实验3:实验4:探究2.复分解型离子反应发生条件的实验探究产生白色沉淀红色逐渐褪去产生无色无味气体Ba2+SO42-数目减少H+OH-数目减少H+CO32-数目减少Ba2+与SO42-结合生成难溶的BaSO4H+与OH-结合生成难电离的H2OH+与CO32-结合生成易挥发的CO2和难电离的H2O2mLNa2CO3溶液稀HCl溶液先滴加两滴酚酞,再慢慢滴加稀HCl溶液2mLNaOH溶液BaCl2溶液2mLNa2SO4溶液KCl溶液2mLNa2SO4溶液无明显现象不反应2、酸、碱、盐之间离子反应发生的条件:有沉淀、气体或水三者之一生成。3、离子反应的实质:某些离子浓度变化。判断下列电解质溶液间能否发生离子反应,并说明理由.①CaCl2与K2CO3②Ba(NO3)2与NaOH③CuSO4与Ba(OH)2④H2SO4与NaOH⑤K2CO3与H2SO4⑥KOH与HNO3⑦NaOH与HCl⑧HCl与NaClXX[课堂练习1]Na2SO4+BaCl2=2NaCl+BaSO4↓2Na++SO42-+Ba2++2Cl-=2Na++2Cl-+BaSO4↓Ba2++SO42+=BaSO4↓2Na++SO42-+Ba2++2Cl-=2Na++2Cl-+BaSO4↓写删拆查以Na2SO4、BaCl2反应为例描述离子反应的书写步骤4、离子方程式的书写步骤写——化学方程式拆——强酸、强碱、可溶性盐删——相同的离子查——质量(原子个数)、电荷守恒写出能发生反应的物质之间的离子反应方程式①CaCl2与K2CO3②Ba(NO3)2与NaOH③CuSO4与Ba(OH)2④H2SO4与NaOH⑤K2CO3与H2SO4⑥KOH与HNO3⑦NaOH与HCl⑧HCl与NaCl2H++CO32-=H2O+CO2↑H++OH-=H2OH++OH-=H2OCa2++CO32-=CaCO3↓Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓H++OH-=H2O[课堂练习2]写出能发生反应的物质之间的离子反应方程式④H2SO4与NaOH⑥KOH与HNO3⑦NaOH与HClH++OH-=H2OH++OH-=H2OH++OH-=H2O[课堂练习2]5.离子方程式表示的意义(1)揭示化学反应实质(2)不仅表示某个化学反应,也可表示一类物质间的化学反应。(2)、写出Cu2++2OH-=Cu(OH)2↓对应的化学方程式。[课堂练习3](1)、从离子反应的角度解释胃舒平(主要成分是氢氧化铝)能够治疗胃酸过多的原因?写出反应的离子方程式。6、离子共存(1)、生成难溶性(或微溶性)、气体、难电离物质时,这些离子就不能大量共存。沉淀:气体:H+与CO32-、S2-、HCO3-等难电离:H+与OH-、CH3COO-等;OH-与H+、HCO3-、HSO3-、NH4+等。下列各组离子能在溶液中大量共存的是()ACl-Na+NO3-Ag+BK+H+OH-Cl-CCO32-Na+Cl-H+DCu2+SO42-Cl-H+D(2)、发生氧化还原反应:氧化性离子:NO3-、ClO-、MnO4-(H+)、Fe3+还原性离子:S2-、I-、Fe2+、SO32-(3)、附加隐含条件的应用规律:①溶液无色透明时,则溶液中一定无有色离子。常见的有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnO4-(紫色)。②强碱性溶液中除题给离子外,还有大量OH-③强酸性溶液中除题给离子外,还有大量H+在无色强酸性溶液中,下列各组离子能够大量共存的是A.Cu2+Ca2+NO3-Cl-B.Na+CO32-Cl-SO42-C.Na+K+SO42-Cl-D.Fe3+Ca2+Cl-NO3-C某无色溶液中,可大量共存的离子组是()A.Na+Ba2+SO42-Cl-B.Cu2+NO3-Cl-SO42-C.K+Cl-Na+CO32-D.K+Ba2+SO42-OH-C离子方程式正误辨析一查反应能否发生。二查反应物、生成物是否正确。三查“=↓↑”、反应条件是否正确、齐全。四查各物质拆分是否正确。五查是否符合守恒关系。六查反应物或生成物的配比是否正确。七查是否漏掉离子反应。铜与稀盐酸:Cu


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高中化学必修1离子反应
链接地址:https://www.777doc.com/doc-3680045 .html