当前位置:首页 > 临时分类 > 人教版高中化学必修一氯及其化合物练习
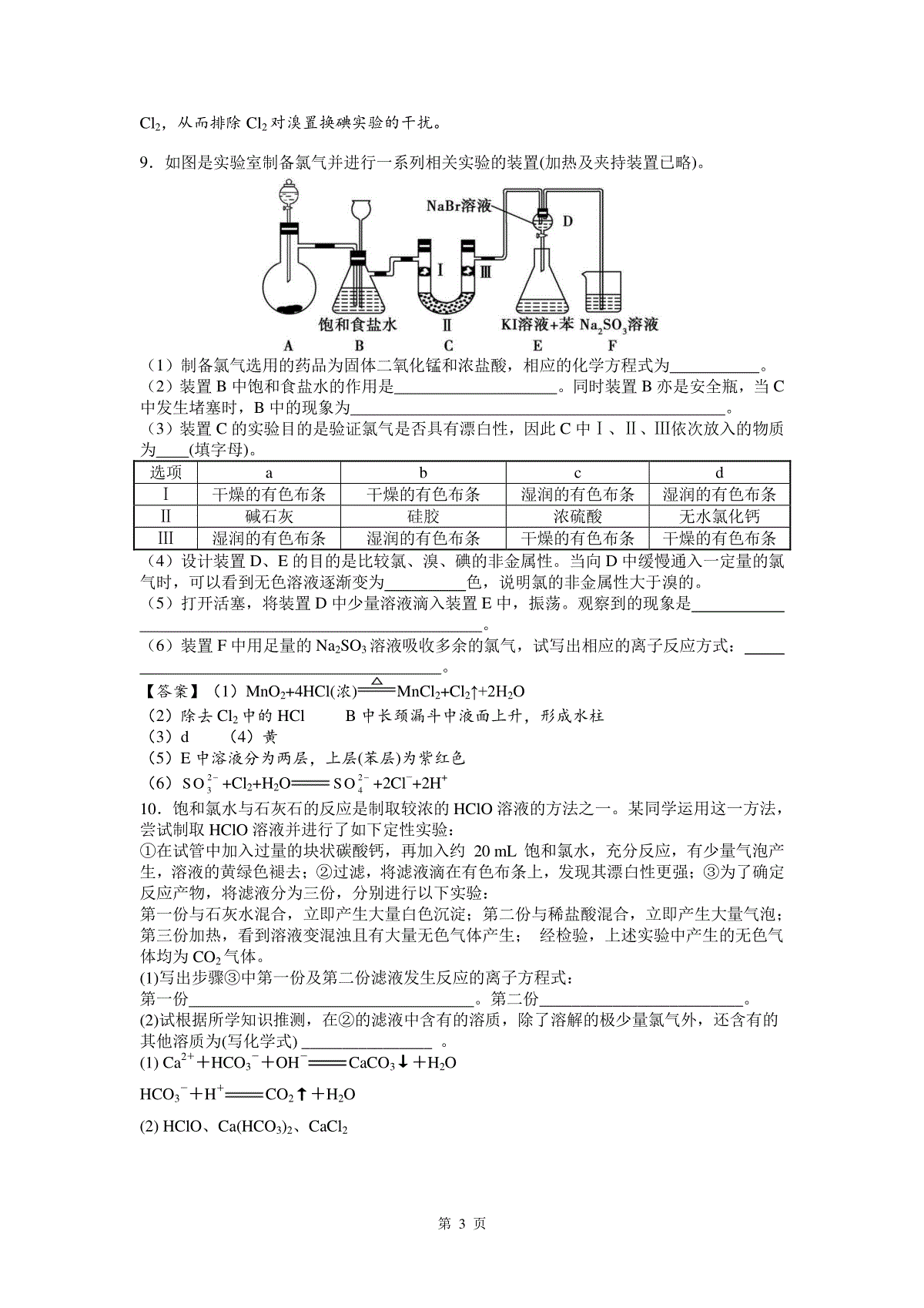
第1页氯及其化合物练习1.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是()A.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在B.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2分子存在C.加入盐酸酸化,再加入硝酸银溶液,产生白色沉淀,说明氯水中有Cl-存在D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在解析:选A。氯气是黄绿色、有刺激性气味的气体,溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在,A正确;HClO有漂白性,能使有色布条褪色,B错误;检验Cl-时不能用盐酸酸化,C错误;加入NaOH溶液与盐酸和次氯酸反应,使氯气与水反应的平衡右移,则氯水的黄绿色消失,D错误。2.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是()A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完B.Ⅲ图中:生成蓝色的烟C.Ⅱ图中:量筒中发生了加成反应D.Ⅳ图中:湿润的有色布条能褪色,将浓硫酸滴入烧杯中至溶液显酸性,结果有Cl2生成解析:选D。二氧化锰和浓盐酸在加热条件下发生氧化还原反应生成氯气,但稀盐酸与二氧化锰不反应,则盐酸不能完全消耗,A错误;氯气与铜反应产生棕黄色的烟,加水后溶液呈蓝色,B错误;氯气和甲烷在光照下发生取代反应,C错误;氯气与水反应生成具有漂白性的HClO,能使湿润的有色布条褪色,Cl2与NaOH反应生成NaCl和NaClO,二者在酸性条件下反应生成氯气,D正确。3.下列离子方程式正确的是()①氯气与水反应:Cl2+H2O===2H++Cl-+ClO-②氯气与氢氧化钠溶液反应:Cl2+2OH-===Cl-+ClO-+H2O③浓盐酸与二氧化锰共热:MnO2+4HCl(浓)===Mn2++2Cl-+Cl2↑+2H2O④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClOA.①③B.②④C.②③D.①④解析:选B。反应①生成的HClO为弱酸,应用HClO表示;反应③中浓盐酸可全部电离,应写成H+和Cl-的形式。4.向含SO2-3、Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是()解析:选C。本题以氧化还原反应过程为载体,旨在考查学生对化学反应图像的识别能力。题中四种离子与Cl2反应的先后顺序依次是SO2-3(消耗2.24LCl2)、I-(消耗1.12LCl2)、Fe2+(消耗1.12LCl2)、Br-(消耗1.12LCl2),因此C选项正确。5.气体X可能含有Cl2、HBr、CO2中的一种或几种,已知X通入AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸;若将X通入澄清石灰水中,却不见沉淀产生。对于气体X的成分,下列说法正确的是()△第2页A.一定含有HBr,可能含有CO2B.一定不含CO2C.一定不含Cl2和CO2D.可能含有CO2和Cl2解析:选A。X通入AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸,则一定含有HBr,由于HBr与Cl2不能共存,则一定不含Cl2;X通入澄清石灰水中,由于HBr能中和澄清石灰水,因此不能确定是否含有CO2,A项正确。6.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是()A.氧化性:ClO-I2SO2-3B.漂白粉溶液可使淀粉碘化钾试纸变蓝C.向氯水中加入亚硫酸钠溶液,氯水褪色D.次氯酸钠可以与亚硫酸钠共存解析:选D。碘化钾与次氯酸钠反应生成了碘单质。其实质是次氯酸根离子将碘离子氧化成碘单质。而碘单质又将亚硫酸根离子氧化成硫酸根离子,所以氧化性:ClO-I2SO2-3,A、B正确,D不正确;C选项氯水中存在氯气分子和次氯酸,都可将亚硫酸根离子氧化,C正确。7.某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀硫酸;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。下列对此过程进行的分析中错误的是()A.加入以上药品的顺序是a→e→b→c→dB.③→④反应的化学方程式为3I2+6NaOH===5NaI+NaIO3+3H2OC.溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色D.④→⑤反应的离子方程式为2I-+Cl2===I2+2Cl-解析:选D溶液颜色变化:①无色→②棕黄色说明有碘生成,②棕黄色→③蓝色说明是碘遇淀粉溶液显色,③蓝色→④无色说明碘被消耗,④无色→⑤蓝色说明又生成了碘,此时发生的是NaI和NaIO3在酸性条件下生成碘的氧化还原反应。8.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……(1)A中产生黄绿色气体,其电子式是_______________。(2)验证氯气的氧化性强于碘的实验现象是____________________________________。(3)B中溶液发生反应的离子方程式是____________________________________。(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________________________。(5)过程Ⅲ实验的目的是_________________________________________。(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________________,得电子能力逐渐减弱。答案(1)(2)湿润的淀粉KI试纸变蓝(3)Cl2+2Br-===Br2+2Cl-(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰(6)原子半径逐渐增大解析A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI===2KCl+I2,Cl2+2NaBr===2NaCl+Br2,Cl2+2NaBr===2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI===2KBr+I2。过程Ⅲ实验,当B中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无第3页Cl2,从而排除Cl2对溴置换碘实验的干扰。9.如图是实验室制备氯气并进行一系列相关实验的装置(加热及夹持装置已略)。(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相应的化学方程式为。(2)装置B中饱和食盐水的作用是。同时装置B亦是安全瓶,当C中发生堵塞时,B中的现象为。(3)装置C的实验目的是验证氯气是否具有漂白性,因此C中Ⅰ、Ⅱ、Ⅲ依次放入的物质为(填字母)。选项abcdⅠ干燥的有色布条干燥的有色布条湿润的有色布条湿润的有色布条Ⅱ碱石灰硅胶浓硫酸无水氯化钙Ⅲ湿润的有色布条湿润的有色布条干燥的有色布条干燥的有色布条(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓慢通入一定量的氯气时,可以看到无色溶液逐渐变为色,说明氯的非金属性大于溴的。(5)打开活塞,将装置D中少量溶液滴入装置E中,振荡。观察到的现象是。(6)装置F中用足量的Na2SO3溶液吸收多余的氯气,试写出相应的离子反应方式:。【答案】(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(2)除去Cl2中的HClB中长颈漏斗中液面上升,形成水柱(3)d(4)黄(5)E中溶液分为两层,上层(苯层)为紫红色(6)23SO+Cl2+H2O24SO+2Cl−+2H+10.饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量气泡;第三份加热,看到溶液变混浊且有大量无色气体产生;经检验,上述实验中产生的无色气体均为CO2气体。(1)写出步骤③中第一份及第二份滤液发生反应的离子方程式:第一份。第二份_________________________。(2)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)________________。(1)Ca2++HCO3-+OH-CaCO3↓+H2OHCO3-+H+CO2↑+H2O(2)HClO、Ca(HCO3)2、CaCl2


 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:人教版高中化学必修一氯及其化合物练习
链接地址:https://www.777doc.com/doc-4282242 .html