当前位置:首页 > 中学教育 > 高中教育 > 原创2015年南方新高考化学广东专用大一轮配套课件第14讲化学反应与能量共54张P
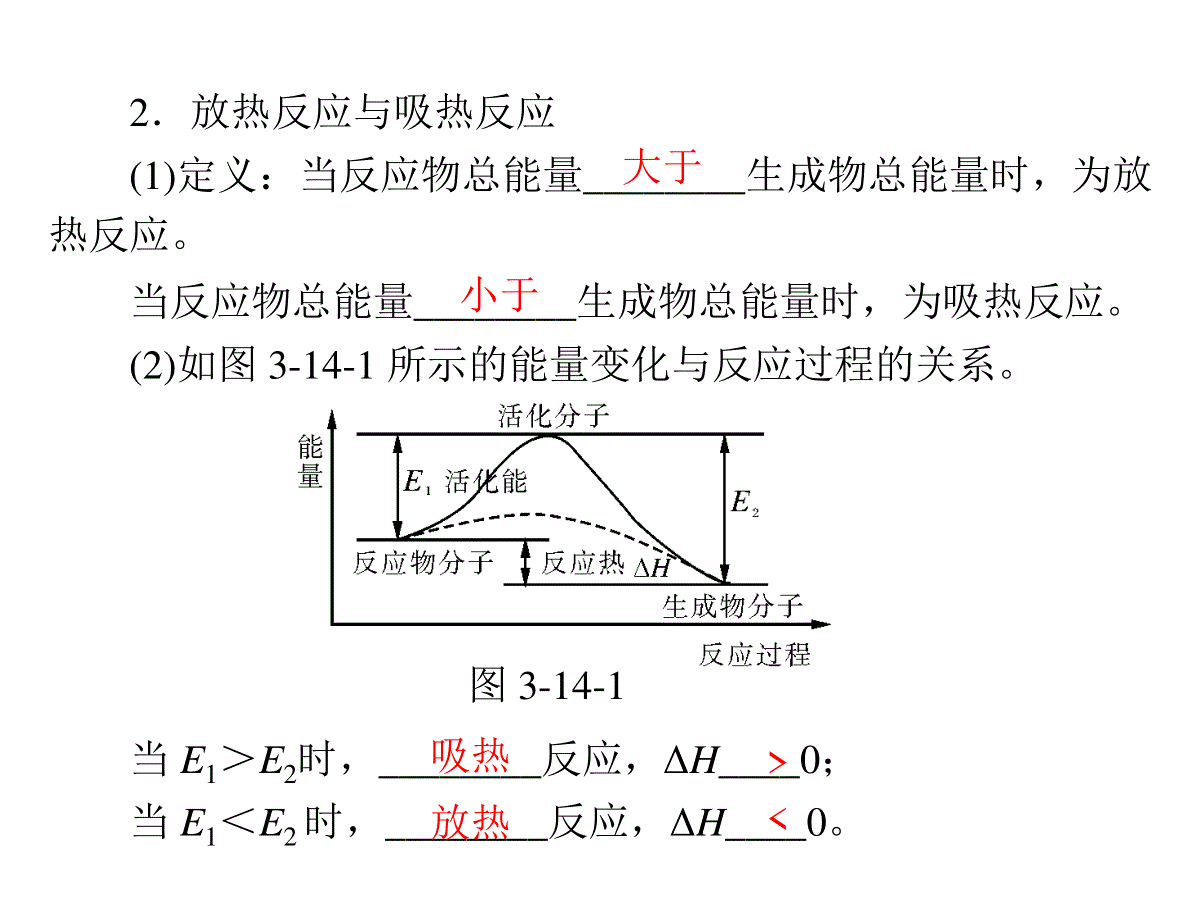
第14讲化学反应与能量考纲定位选项示例1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。1.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键。(2011年浙江高考T12—C)2.应用盖斯定律,可计算某些难以直接测定的反应焓变。(2010年山东高考T10—C)3.常温下,反应C(s)+CO2(g)===CO(g)不能自发进行,则该反应的ΔH>0。(2010年江苏高考T8—B)一、反应热1.焓变(1)定义:在恒压条件下进行的反应的______________。符号:______,单位:__________。(规定:放热反应的ΔH取“-”,吸热反应的ΔH取“+”)(2)化学反应产生能量变化的主要原因在于反应物的总能量和生成物的总能量不尽相同,在破坏化学键和形成化学键的过程中能量变化不相等,使得化学反应总是伴随着能量变化。热效应ΔHkJ·mol-12.放热反应与吸热反应(1)定义:当反应物总能量________生成物总能量时,为放热反应。当反应物总能量________生成物总能量时,为吸热反应。(2)如图3-14-1所示的能量变化与反应过程的关系。当E1>E2时,________反应,ΔH____0;当E1<E2时,________反应,ΔH____0。图3-14-1大于小于吸热放热ΔH=-571.6kJ·mol-1,表示3.热化学方程式(1)定义:表示参加反应的物质的________和__________的关系的化学方程式。(2)意义:表明了变化过程中的__________和__________。例如,2H2(g)+O2(g)===2H2O(l)-在25℃、101kPa条件下,_______________________________________________________________________。(3)书写步骤:写热化学方程式一般要先写出反应过程,注明各物质的状态,再计算反应热,写出热化学方程式。量反应热物质变化能量变化2molH2(g)和1molO2(g)完全反应生成2molH2O(l)时释放571.6kJ的能量(4)有关热化学方程式书写及判断的4点注意事项:①注意标明物质的聚集状态;②注意ΔH的符号与单位;③注意ΔH的数值与计量数是否对应;④注意燃烧热、中和热等条件的限制。ΔH=-285.8kJ·mol-1。二、燃烧热与中和热1.燃烧热(1)定义:在25℃、101kPa时,________纯物质________燃烧生成_________的氧化物时所放出的热量。单位为(2)意义:H2的燃烧热为-285.8kJ·mol-1,表示在25℃、101kPa条件下,________________________________________________________________,用热化学方程式表示为:H2(g)+1/2O2(g)===H2O(l)kJ·mol-1。1mol完全稳定1molH2完全燃烧生成H2O(l)时放出的热量为285.8kJ2.中和热酸跟碱发生中和反应生成1molH2O定义:在稀溶液中,__________________________________时放出的热量叫中和热。三、能源四、盖斯定律1.定义不管化学反应是一步完成或分几步完成,其反应热是________的。反应热只和_________________________有关,而与____________无关。2.举例如图3-14-2,始态为S,终态为L,中间过程为R,则有ΔH=____________________。相同反应体系的始态和终态ΔH1+ΔH2图3-14-2反应途径考点1放热反应与吸热反应区别类型放热反应吸热反应反应特征反应过程中放出热量反应过程中吸收热量形成原因反应物的总能量大于生成物的总能量反应物的总能量小于生成物的总能量与化学键的关系反应物化学键断裂时吸收的总能量小于生成物化学键形成时释放的总能量反应物化学键断裂时吸收的总能量大于生成物化学键形成时释放的总能量焓变的大小ΔH0ΔH0区别类型放热反应吸热反应图示实例①燃烧反应;②活泼金属跟酸反应;③酸碱中和反应;④多数化合反应①氢氧化钡晶体与氯化铵晶体的反应;②以C、H2、CO为还原剂冶炼金属的氧化还原反应;③多数分解反应(续表)(1)常见的放热反应:燃烧反应、中和反应、大多数化合反应、活泼金属与强酸的反应、铝热反应、钠与水的反应等。(2)常见的吸热反应:水解反应、大多数分解反应、一些需持续加热才能发生的反应、碳与二氧化碳的反应、氢氧化钡晶体与氯化铵的反应等。【例1】(2012年重庆高考)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图3-14-3所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942,O==O为500,N—N为154,则断裂1molN—H键所需的能量(kJ)是()。A.194B.391C.516D.658图3-14-3思路指导:本题考查反应热的计算:ΔH=反应物的总键能-生成物的总键能,从反应热计算入手。答案:B解析:设N—H键的键能为y,则:-534kJ·mol-1=4y+154kJ·mol-1+500kJ·mol-1-2752kJ·mol-1,解得y=391kJ·mol-1。化学键Cl-ClBr-BrI-IH-ClH-BrH-IH-H键能(kJ·mol-1)243193151432366298436【例2】下表中是一些化学键键能的数据:根据上述数据回答下列问题:(1)下列物质本身具有的能量最低的是()。A.H2B.Cl2C.Br2D.I2(2)X2+H2===2HX(X代表卤素原子)的反应是______(填“吸热”或“放热”)反应。(3)相同条件下,等物质的量的Cl2、Br2、I2分别与足量的氢气反应,放出或吸收的热量最多的是____________。解析:化学键的键能越大,化学键断裂时需要吸收的能量越多,物质越稳定。根据ΔH=反应物的总键能-生成物的总键能,可得出第(2)和(3)问的结论。答案:(1)A(2)放热(3)Cl2考点2热化学方程式的书写及正误判断1.书写热化学方程式的注意事项(1)ΔH只能写在标有反应物和生成物聚集状态的化学方程式的右边,若为放热反应,ΔH0;若为吸热反应,ΔH0。(2)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,不能表示物质的个数。因此化学计量数可以是整数,也可以是分数,且必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。(ΔH的单位一般为kJ·mol-1)(3)反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。因此,必须注明物质的聚集状态(s、l、g)才能完整地体现热化学方程式的意义。热化学方程式中不用标“↑”“↓”和反应条件。(4)当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。(5)用中文表示焓变时数值没有正负号,而用符号表示焓变变时数值必须注明正负号。如H2的燃烧热为285.8kJ·mol-1,ΔH=-285.8kJ·mol-1。2.热化学方程式书写正误的判断方法(1)检查是否标明物质的聚集状态。(2)检查ΔH的“+”、“-”是否与吸热、放热一致。(3)检查ΔH的数值是否与反应物或生成物的物质的量相对应(成比例)。【例3】下列热化学方程式书写正确的是()。A.已知2H2O(g)===2H2(g)+O2(g)ΔH=+483.6kJ·mol-1,则氢气的燃烧热为ΔH=-241.8kJ·mol-1B.已知C(石墨,s)===C(金刚石,s)ΔH>0,则金刚石不如石墨稳定C.已知中和热为ΔH=-57.4kJ·mol-1,则稀醋酸和稀NaOH溶液反应的热化学方程式为:CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.4kJ·mol-1D.已知2C(s)+2O2(g)===2CO2(g)ΔH1;2C(s)+O2(g)===2CO(g)ΔH2,则ΔH1>ΔH2思路指导:注意热化学方程式书写的易错点。解析:H2的燃烧热为1molH2(g)完全燃烧生成1molH2(l)放出的热量,此处为气态水,无法计算,A错误;能量越低物质越稳定,金刚石能量比石墨高,故石墨稳定,B正确;醋酸电离吸热,反应放出的热量值小于57.4,C错误;C完全燃烧放出的热量大于不完全燃烧放出的热量,但是ΔH为负值,故ΔH1<ΔH2,D错误。答案:B考点3燃烧热中和热1.燃烧热理解燃烧热时应注意的问题:(1)“纯物质”特指纯净物,可燃的混合物不存在所谓燃烧热。“稳定的氧化物”特指在25℃、101kPa时所有可能产生的燃烧产物中最稳定的一种。(2)单位:虽是燃烧“热”,但由于限定是1mol纯物质完(3)燃烧都是放热反应,所以燃烧反应ΔH0。全燃烧产生的,因此单位为kJ·mol-1。(4)书写表示某物质燃烧热的热化学方程式时,要使该反应物的化学计量数为1,其余反应物和生成物的化学计量数则相应配平。(5)常见元素完全燃烧生成稳定的氧化物:C→CO2(g),H→H2O(l),S→SO2(g)。2.中和热理解中和热时要注意的问题:c(OH-)≤1mol/L),因为浓酸、浓碱溶液稀释时会放出热量。(2)弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ·mol-1。(3)溶液的聚集状态用“aq”表示,生成产物H2O必须是1mol。(4)常温时,中和热ΔH=-57.3kJ·mol-1。(1)参加反应的酸碱浓度应比较小(一般溶液中的c(H+)或【例4】下列说法正确的是()。A.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热B.25℃、101kPa时,1molS和2molS的燃烧热相等C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热思路指导:本题考查中和热和燃烧热的准确理解,注意两个概念对反应物或生成物的物质的量的要求,温度、压强对反应热有一定影响,物质的聚集状态不同,反应热也不同。解析:1molH2SO4和1molBa(OH)2完全中和时生成2molH2O,A错误;燃烧热与实际燃烧的硫的物质的量无关,B正确;C不完全燃烧产生的CO是一种良好的气体燃料,其燃烧反应一定是放热反应,C错误;燃烧热是温度和压强的函数,不同温度下测得的反应热是不同的,故未指明温度谈燃烧热无意义,且若碳不完全燃烧所放出的热量也不能称为燃烧热,D错误。答案:B甲――→乙,甲――→丙――→乙,ΔH=ΔH1+ΔH2。考点4盖斯定律1.定义:化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。即ΔHΔH1ΔH22.应用:计算反应热,书写热化学方程式。(1)利用关系图找出反应热之间的关系。①找起点和终点(起点是A,终点是C);②找途径:一个是A→B→C,一个是A→C;③列式:ΔH3=ΔH1+ΔH2。(2)利用方程组找出反应热之间的关系。①找出中间产物(中间产物是B);②利用方程组消去中间产物:反应c=反应a+反应b;③列式:ΔH3=ΔH1+ΔH2。【例5】已知:2Zn(s)+O2(g)===2ZnO(s)ΔH=-701.0kJ·mol-1;2Hg(l)+O2(g)===2HgO(s)ΔH=-181.6kJ·mol-1。则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为()。A.+519.4kJ·mol-1B.+259.7k




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:原创2015年南方新高考化学广东专用大一轮配套课件第14讲化学反应与能量共54张P
链接地址:https://www.777doc.com/doc-5788543 .html