当前位置:首页 > 中学教育 > 高中教育 > 江苏专用2021高考化学一轮复习专题8化学反应速率和化学平衡练习含解析
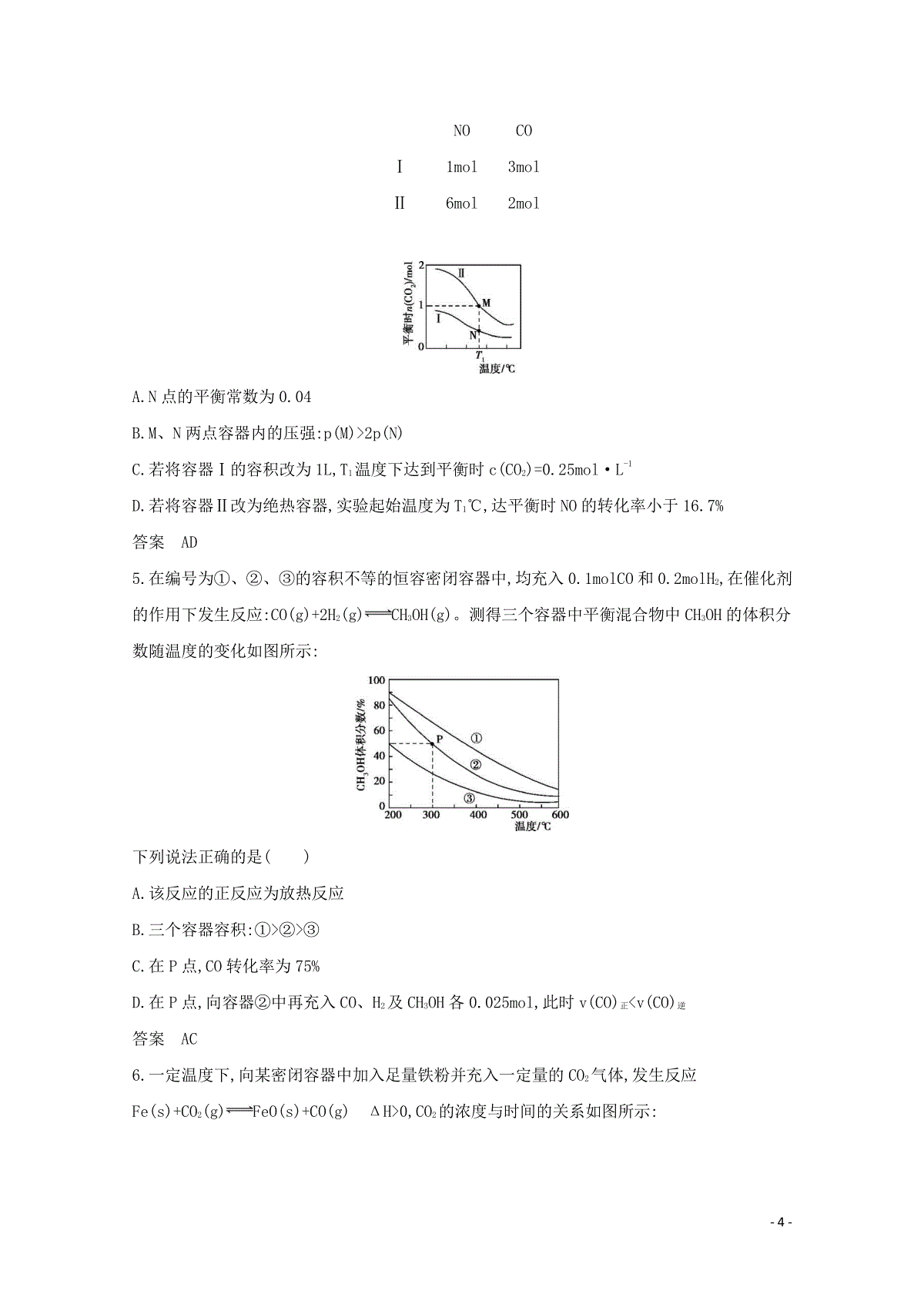
-1-专题8化学反应速率和化学平衡备考篇提纲挈领【考情探究】课标解读考点化学反应速率化学平衡状态和化学平衡常数影响化学平衡移动的因素有关化学平衡的计算解读1.了解化学反应速率的概念和定量表示方法2.了解反应活化能的概念,了解催化剂的重要作用3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释其一般规律1.了解化学反应的可逆性及化学平衡的建立2.掌握化学平衡的特征1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律2.了解化学反应速率和化学平衡的调控在生活、生产和科研领域中的重要作用1.能正确计算化学反应的转化率(α)2.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算考情分析本专题的考题以中等题或难题为常见。设题形式通常有选择题和填空题备考指导2021年高考备考重点关注化学反应速率、化学平衡状态和化学平衡常数等基础知识。狠练基本功,站得稳,才能飞得高【真题探秘】-2-基础篇固本夯基【基础集训】考点一化学反应速率1.向体积均为2L的两个恒容密闭容器中分别充入1molSiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)ΔH=akJ·mol-1,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是()A.T1T2B.T1℃时,0~100min反应的平均速率v(SiHCl3)=0.001mol·(L·min)-1C.T2℃时,反应的平衡常数:K=1D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同答案AC2.下列图示与对应的叙述相符的是()-3-A.图1表示恒温恒容条件下,反应N2+3H22NH3中c(NH3)与反应时间的关系,NH3的生成速率a点大于b点B.图2表示1LpH=12CH3COONa溶液加水稀释至VL,溶液pH随lgV的变化关系图C.图3表示AgCl在水中的沉淀溶解平衡曲线,a、b、c三点中a点表示不饱和溶液D.图4表示用0.01mol·L-1NaOH溶液滴定20mL0.01mol·L-1H2SO4溶液时pH的变化答案C3.一定温度时,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)2SO3(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:t/s0t1t2t3t4n(SO3)/mol00.81.41.81.8下列说法正确的是()A.反应在0~t1s内v(O2)=0.1mol·L-1·s-1B.保持其他条件不变,将体积压缩到1.0L,平衡常数不变C.平衡时,再向容器中充入1molSO2和1molSO3,平衡向逆反应方向移动D.保持温度不变,向该容器中再充入2molSO2、1molO2,反应达到新平衡时n(SO3)/n(O2)增大答案BD考点二化学平衡状态和化学平衡常数4.两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器在不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是()容器起始物质的量-4-NOCOⅠ1mol3molⅡ6mol2molA.N点的平衡常数为0.04B.M、N两点容器内的压强:p(M)2p(N)C.若将容器Ⅰ的容积改为1L,T1温度下达到平衡时c(CO2)=0.25mol·L-1D.若将容器Ⅱ改为绝热容器,实验起始温度为T1℃,达平衡时NO的转化率小于16.7%答案AD5.在编号为①、②、③的容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是()A.该反应的正反应为放热反应B.三个容器容积:①②③C.在P点,CO转化率为75%D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时v(CO)正v(CO)逆答案AC6.一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)ΔH0,CO2的浓度与时间的关系如图所示:-5-①该温度下反应的平衡常数的值为;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度为mol·L-1。②下列措施中能使平衡时c(CO)/c(CO2)增大的是(填序号)。A.升高温度B.增大压强C.再充入一定量的CO2D.再加入一定量铁粉③一定温度下,在一个容积固定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母)。A.容器中的压强不变B.气体的密度不再改变C.v正(CO2)=v逆(CO)D.c(CO2)=c(CO)E.容器内气体总物质的量不变答案①2.00.67(或2)②A③BC考点三影响化学平衡移动的因素7.在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g)2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O平衡转化率如右下图所示:容器容积/L起始物质的量/molN2ON2O2ⅠV10.100Ⅱ1.00.100ⅢV30.100Ⅳ1.00.060.060.04下列说法正确的是()A.该反应的正反应放热-6-B.相同温度下反应时,平均反应速率:v(Ⅰ)v(Ⅲ)C.图中A、B、C三点处容器内总压强:p(Ⅰ)Ap(Ⅱ)Bp(Ⅲ)CD.容器Ⅳ在70℃进行反应时,起始速率:v(N2O)正v(N2O)逆答案CD8.一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=-9.0kJ·mol-1,测得n(H2)随时间变化如曲线Ⅰ所示。下列说法正确的是()A.该反应在0~8min内CO2的平均反应速率是0.75mol·L-1·min-1B.若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的体积分数大于20%C.若起始时向上述容器充入4molCO2(g)、2molH2(g)、2molCH3OH(g)和1molH2O(g),则此时反应向正反应方向进行D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气答案BC考点四有关化学平衡的计算9.一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)COCl2(g),其中容器Ⅰ中5min时达到平衡。容器编号温度/℃起始时物质的量/mol平衡时物质的量/molCOCl2COCl2COCl2Ⅰ5001.01.000.8Ⅱ5001.0a00.5Ⅲ6000.50.50.50.7下列说法中正确的是()A.容器Ⅰ中前5min的平均反应速率v(CO)=0.1mol·L-1·min-1-7-B.该反应正反应为吸热反应C.容器Ⅱ中起始时Cl2的物质的量为0.55molD.若起始时向容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%答案C10.已知:CH4(g)+2H2S(g)CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,平衡时各物质的物质的量分数随温度的变化如下图所示:下列说法正确的是()A.该反应的ΔH0B.X点CH4的转化率为20%C.X点与Y点容器内压强比为55∶51D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)v(逆)答案BD11.甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)CO2(g)+2H2(g)ΔH0,有关实验数据如下表所示:容器容积/L温度/℃起始量/mol平衡量/mol平衡常数C(s)H2O(g)H2(g)甲2T12.04.03.2K1乙1T21.02.01.2K2下列说法正确的是()A.K1=12.8B.T1T2C.T1℃时向甲容器中再充入0.1molH2O(g),则平衡正向移动,CO2(g)的体积分数增大-8-D.若在T2℃下,向2L密闭容器中充入1.0molCO2和2.0molH2,达平衡时,CO2的转化率小于40%答案AD综合篇知能转换【综合集训】1.(2020届南通调研,14)根据下列图示所得出的结论正确的是()A.图甲表示某反应过程中的能量变化曲线,可推知该反应是吸热反应B.图乙表示70℃时不同碱性条件下H2O2的浓度随时间变化的曲线,可推知溶液碱性越强,H2O2分解速率越慢C.图丙表示部分物质的溶解度随温度变化的曲线,可推知20℃时向含amolNaClO4的饱和溶液中加入amolNH4Cl固体会有NH4ClO4固体析出D.图丁表示光照下氯水的pH随时间的变化曲线,可推知光照后溶液中Cl2浓度增大答案C2.(2020届南通栟茶中学学情监测,15)一定条件下合成乙烯:6H2(g)+2CO2(g)CH2CH2(g)+4H2O(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是()A.该反应的ΔH0-9-B.平衡常数:KMKNC.生成乙烯的速率:v(M)一定小于v(N)D.若投料比n(H2)∶n(CO2)=∶1,则图中M点时,乙烯的体积分数约为7.7%答案AD3.(2019扬州期中,10)下列图示与对应的叙述相符合的是()A.A图表示已达平衡的反应在t0时刻改变某一条件后,反应速率随时间的变化,则改变的条件可能是缩小容器体积B.B图表示某可逆反应物质的浓度随反应时间的变化,且在t0时刻达到化学平衡状态C.C图表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化D.D图表示用0.100mol·L-1NaOH溶液滴定20.00mL0.100mol·L-1醋酸溶液的滴定曲线答案A4.(2018苏锡常镇调研二,9)钯(Pd)可作汽车尾气CO、NO和HC(碳氢化合物)转化的催化剂,Pd负载量不同或不同工艺制备的纳米Pd对应汽车尾气处理的结果如图所示。下列说法不正确的是()-10-A.图甲表明,其他条件相同时,三种尾气的转化率随Pd负载量的增大先升后降B.图乙表明,尾气的起燃温度随Pd负载量的增大先降后升C.图甲和图乙表明,Pd负载量越大催化剂活性越高D.图丙和图丁表明,工艺2制得的催化剂Pd的性能优于工艺1答案C应用篇知行合一【应用集训】1.(2020届南通海门中学质检,15)一定温度下,在3个体积均为2L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)达到平衡。已知Ⅰ中的反应经过40min后达到平衡,则下列说法正确的是()容器温度/K起始物质的量(mol)平衡时n(CH3OH)/moln(H2)n(CO)n(CH3OH)Ⅰ4000.200.1000.080Ⅱ4000.200.100.10Ⅲ5000.200.100A.容器Ⅰ中反应在0~40min内的平均速率为v(H2)=0.0020mol·L-1·min-1B.容器Ⅱ中起始反应速率:v正v逆C.达平衡时,容器Ⅰ与容器Ⅱ中H2的物质的量关系:2nⅠ(H2)nⅡ(H2)D.达平衡时,若容器Ⅲ中H2的物质的量大于0.040mol,则该反应ΔH0答案AC2.(2019宿迁期末,15)一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)ΔH0,测得反应的相关数据如下表:容器1容器2容器3反应温度T/K600600500反应物投入量0.2molCO0.4molH20.4molCO0.8molH20.2molCH3OCH30.2molH2O平衡v(CO)/(mol·L-1·s-1)v1v2v3-11-平衡n(H2)/mol0.2n2n3平衡体系总压强p/Pap1p2p3物质的平衡转化率αα1(CO)α2(CO)α3(CH3OCH3)平衡常数KK1K2K3下列说法正确的是()A.v1v2,n20.4B.K2=2.5×103,p




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:江苏专用2021高考化学一轮复习专题8化学反应速率和化学平衡练习含解析
链接地址:https://www.777doc.com/doc-7333730 .html