当前位置:首页 > 行业资料 > 冶金工业 > 《氮及氮的固定》PPT课件
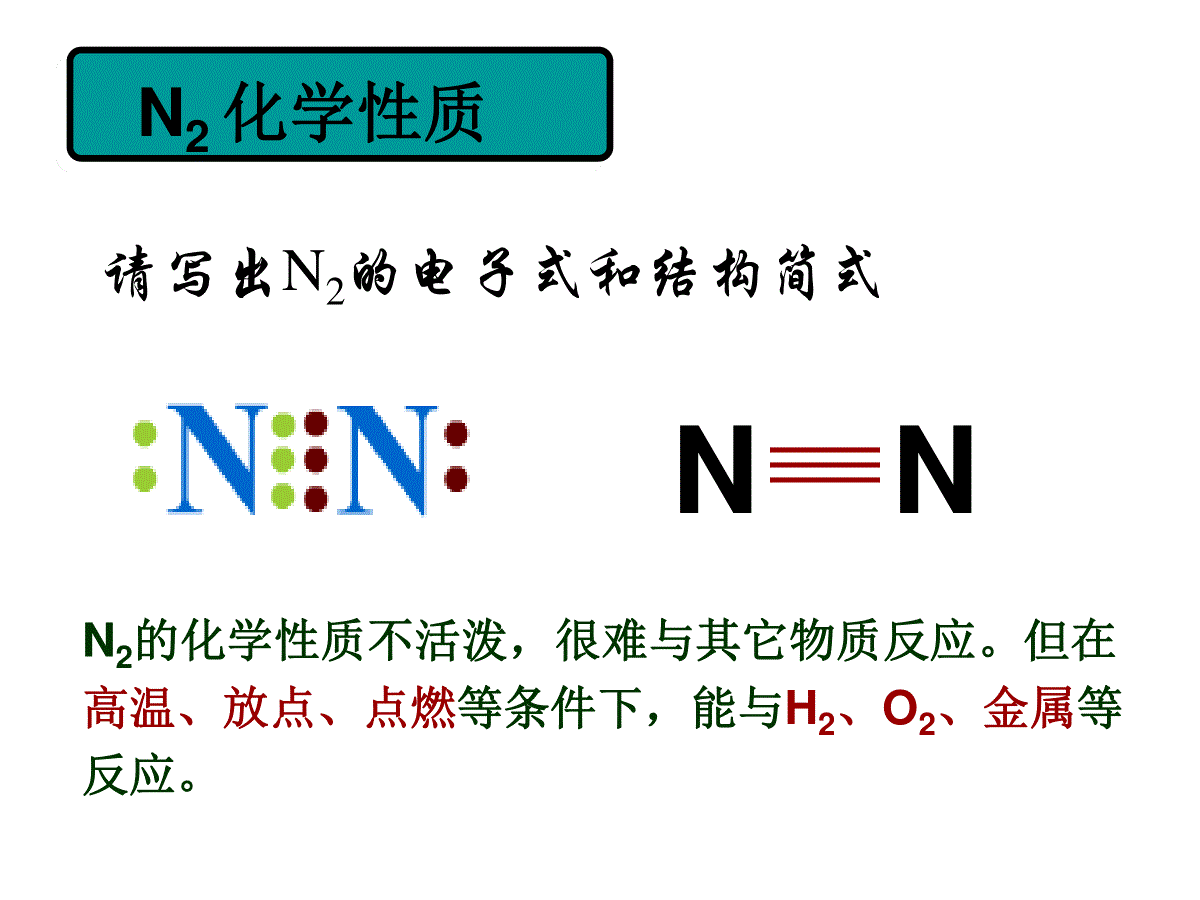
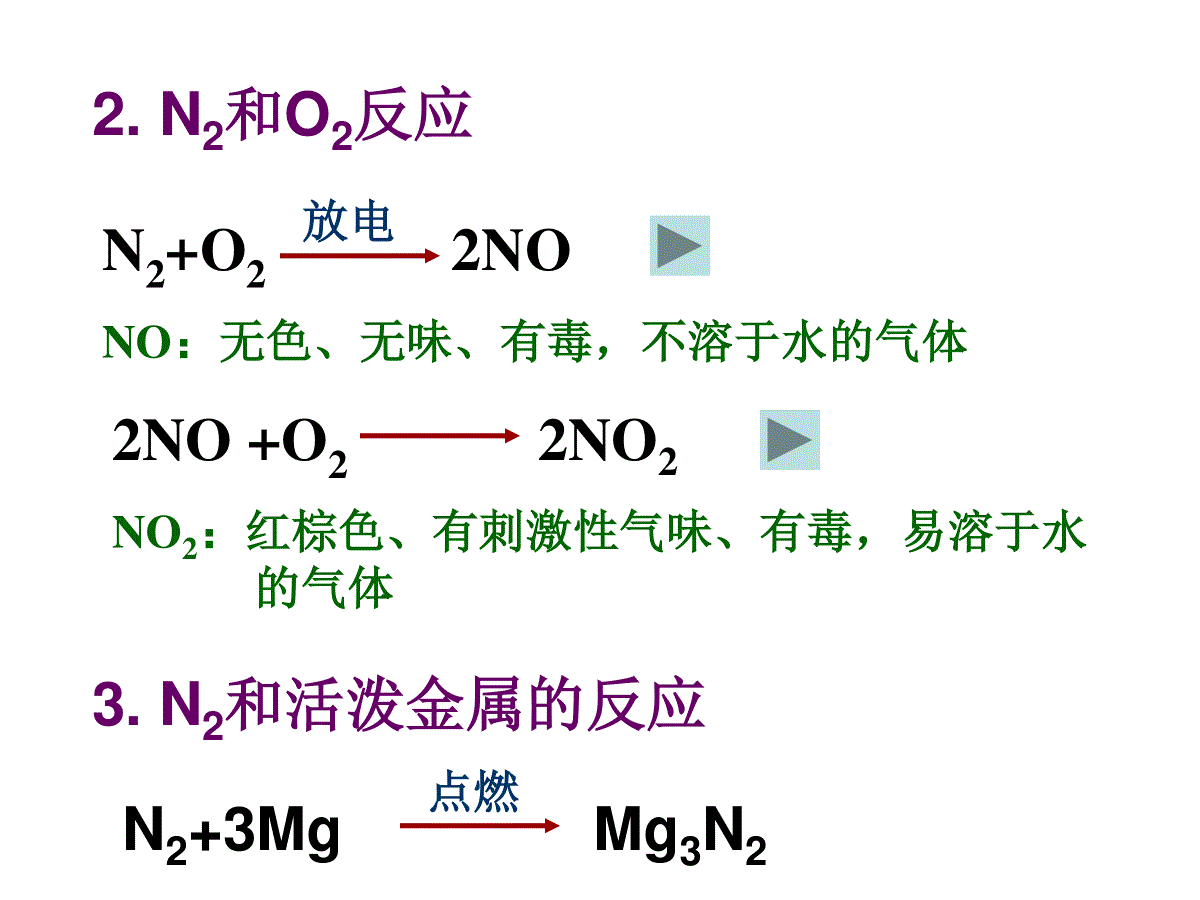
氮气及氮的固定N2物理性质含量:状态:密度:溶解性:沸点:大气中体积分数78%无色无味的气体比空气小难溶于水(1:0.02)O2(工业上利用液化空气,然后升温法分离N2)N2化学性质请写出N2的电子式和结构简式NNN2的化学性质不活泼,很难与其它物质反应。但在高温、放点、点燃等条件下,能与H2、O2、金属等反应。1.N2和H2反应N2+3H22NH3工业合成氨高温高压催化剂2.N2和O2反应N2+O22NO放电2NO+O22NO2NO:无色、无味、有毒,不溶于水的气体NO2:红棕色、有刺激性气味、有毒,易溶于水的气体3.N2和活泼金属的反应N2+3MgMg3N2点燃氮气的工业制法空气(N2、O2)液化液态空气蒸馏N2O2保护气、冷藏食品致冷剂制氨气、硝酸、化肥、炸药氮的用途氮的氧化物-3、+1、+2、+3、+4、+5氮元素化合价:氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5※N2O3和N2O5分别是HNO2和HNO3的酸酐,其余为不成盐氧化物※均有毒1.N2O:又称笑气,无色有甜味气体,是一种氧化剂,有轻微麻醉作用,并能致人发笑。2.NO物理性质:无色、无味、有毒,不溶于水的气体化学性质:既有氧化性,又有还原性(主)2NO+O22NO2NO+NO2+NaOH→NaNO2+H2O22制法:实验室Cu+HNO3(稀)→工业上NH3+O2→NO+H2O4645催化剂收集方法?排水法3.NO2:物理性质:红棕色、有刺激性气味、有毒,易溶于水化学性质:2NO2N2O432NO2+H2OHNO3+NO氧化性:NO2+SO2→SO3+NO制法:实验室Cu+HNO3(浓)→收集方法?向上排空气法光化学烟雾(污染)-NOx主要来自石油产品和煤燃烧、汽车尾气以及制硝酸工厂的废气。①碱液吸收法NO+NO2+2NaOH→2NaNO2+H2O2NO2+2NaOH→NaNO2+NaNO3+H2O消除污染的主要方法:①碱液吸收法NO+NO2+2NaOH→2NaNO2+H2O2NO2+2NaOH→NaNO2+NaNO3+H2O646856712催化剂△△②NH3还原法:NO+NH3→N2+H2ONO2+NH3→N2+H2O化合态游离态氮的固定氮的固定自然固氮人工固氮:合成氨、仿生固氮大气固氮:如闪电生物固氮:如豆科植物氮的固定在新疆和青海两省交界处有一狭长山谷,有时牧民和牲畜进入后,风和日丽的晴天顷刻间电闪雷鸣、狂风大作,人畜皆遭雷击而亡,奇怪的是这里的牧草茂盛、四季常青,被当地牧民称为“魔鬼谷”。中国有句谚语叫“一场雷雨一场肥”,你如何理解这句话?①豆科植物根瘤菌把氮气转化变为硝酸盐等含氮化合物;②在放电的条件下与氧气结合生成氮氧化物并随雨水进入水体及土壤中。(1)游离态化合态(2)化合态化合态①植物经过复杂的生物转化将铵离子、硝酸盐转化为氨基酸,最后转化为蛋白质;②动物将获得的植物蛋白转化为动物蛋白;③微生物将动物蛋白分解为铵离子、硝酸盐和氨气。自然界中氮的循环实验步骤现象反应1将充满NO2的集气瓶倒扣在水槽中红棕色逐渐消失,集气瓶中水位上升3NO2+H2O→2HNO3+NO2往集气瓶中通入氧气无色气体变为红棕色,水位继续上升,红棕色又消失2NO+O2→2NO23NO2+H2O→2HNO3+NO3继续通入氧气现象同2水逐渐充满集气瓶2NO+O2→2NO23NO2+H2O→2HNO3+NO4NO2+2H2O+O2→4HNO3NO2与O2的混合气体溶于水:若V(NO2)∶V(O2)=4∶1,若V(NO2)∶V(O2)4∶1,若V(NO2)∶V(O2)4∶1,则容器内无气体剩余,水可充满容器。则NO2过量,容器内剩余气体为的NO,体积为过量的NO2的1/3。则O2过量,容器内剩余气体为过量的O2。若V(NO)∶V(O2)=4∶3,若V(NO)∶V(O2)4∶3,若V(NO)∶V(O2)4∶3,则容器内无气体剩余,水可充满容器。则容器内剩余气体为过量的NO。则容器内剩余气体为过量的O2。NO与O2的混合气体溶于水:4NO+3O2+2H2O→4HNO3NO与NO2混合气体溶于水:反应最后得到的气体是NO,其体积=V(NO)+1/3V(NO2)NO2、NO与O2三种气体溶于水:若V(NO2)∶V(NO)∶V(O2)=1∶1∶1,则容器内无气体剩余,水可充满容器。例1.将一只充满NO2和NO气体的试管倒立于水槽中,不断摇动试管,使气体充分反应,最后水面上升到试管体积的一半,则混合气体中NO2和NO的体积比是多少?例2.新课标p.69(2)p.70(10)



 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:《氮及氮的固定》PPT课件
链接地址:https://www.777doc.com/doc-5270726 .html