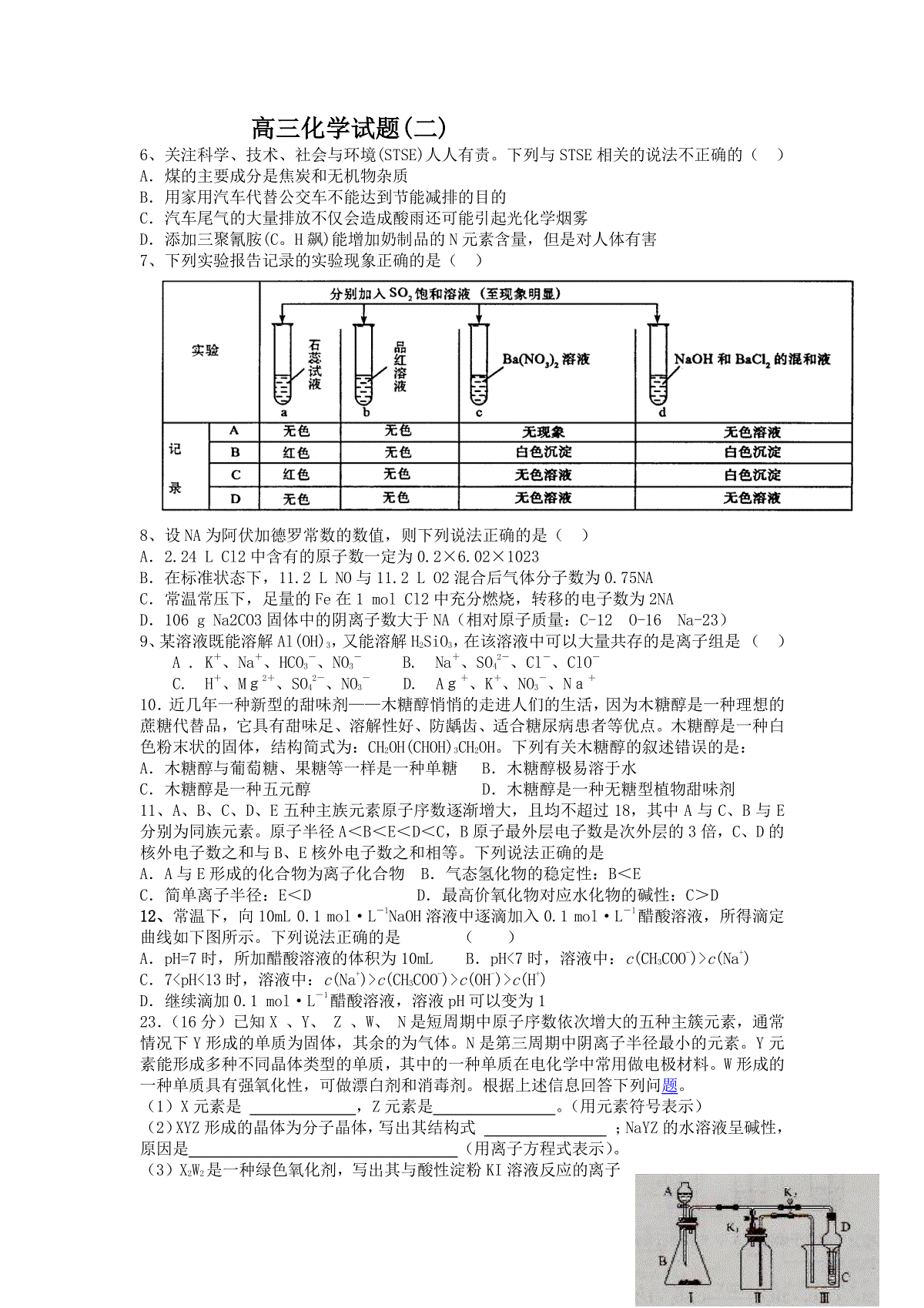
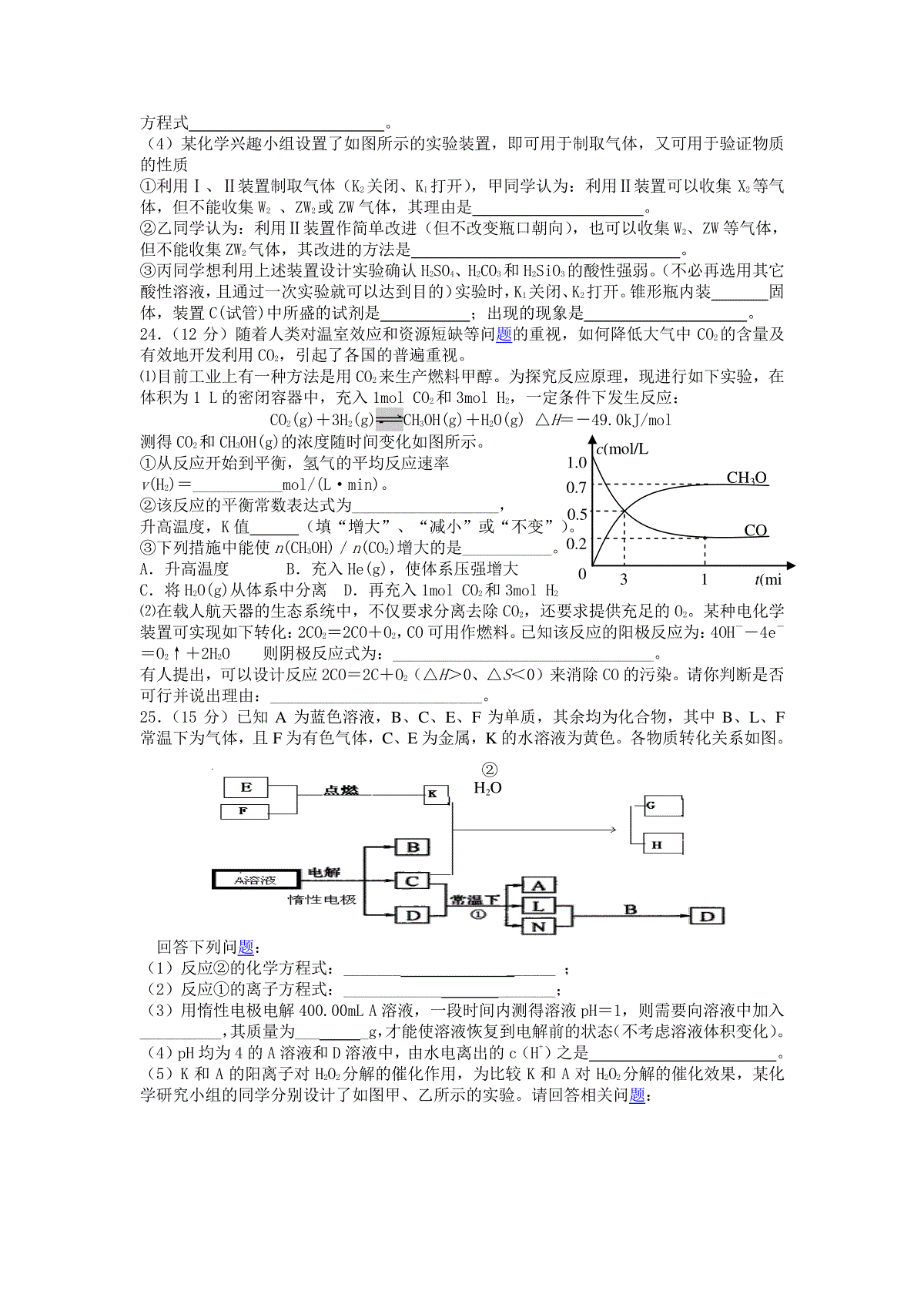
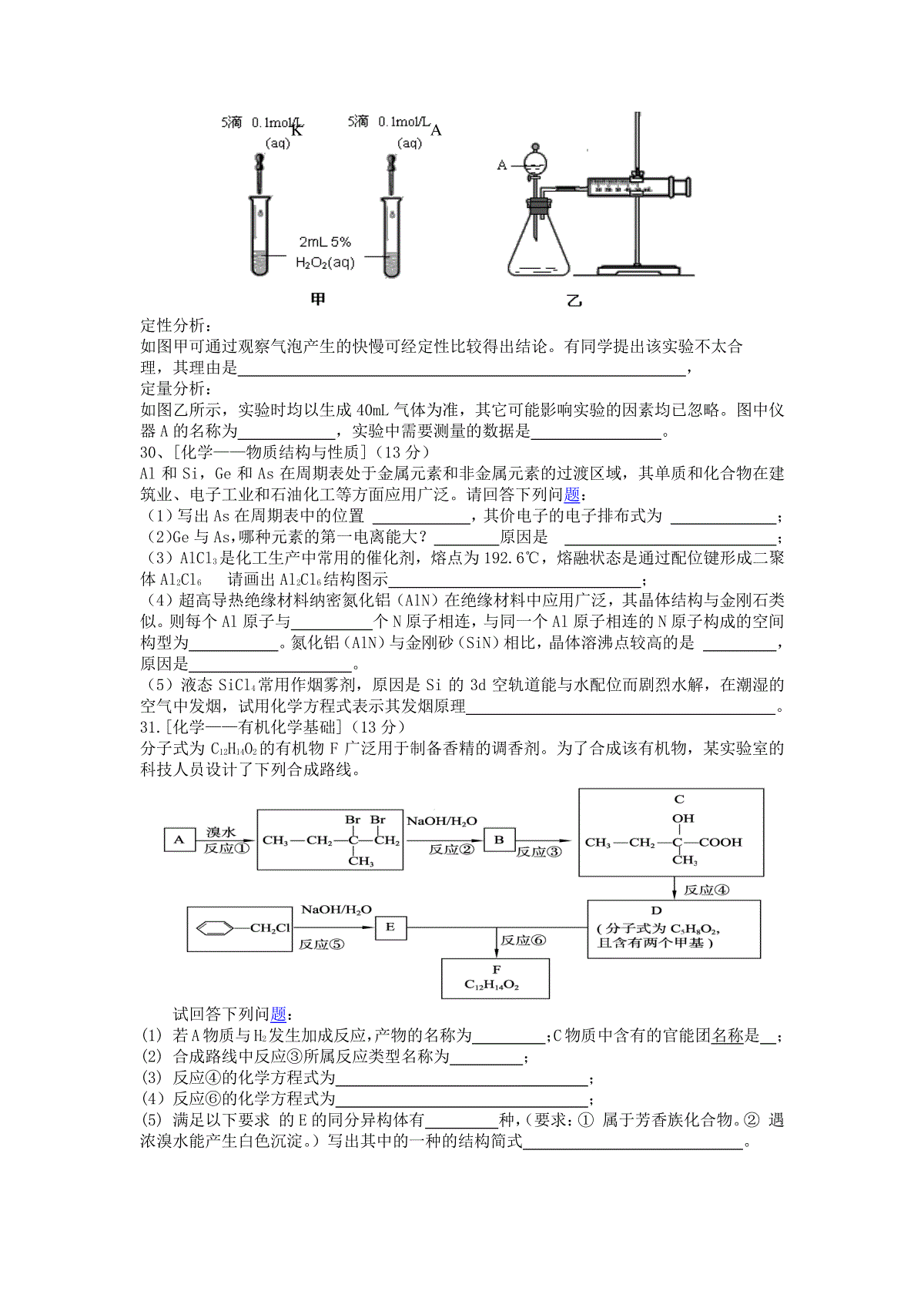
高三化学试题(二)6、关注科学、技术、社会与环境(STSE)人人有责。下列与STSE相关的说法不正确的()A.煤的主要成分是焦炭和无机物杂质B.用家用汽车代替公交车不能达到节能减排的目的C.汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾D.添加三聚氰胺(C。H飙)能增加奶制品的N元素含量,但是对人体有害7、下列实验报告记录的实验现象正确的是()8、设NA为阿伏加德罗常数的数值,则下列说法正确的是()A.2.24LCl2中含有的原子数一定为0.2×6.02×1023B.在标准状态下,11.2LNO与11.2LO2混合后气体分子数为0.75NAC.常温常压下,足量的Fe在1molCl2中充分燃烧,转移的电子数为2NAD.106gNa2CO3固体中的阴离子数大于NA(相对原子质量:C-12O-16Na-23)9、某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是()A.K+、Na+、HCO3-、NO3-B.Na+、SO42-、Cl-、ClO-C.H+、Mg2+、SO42-、NO3-D.Ag+、K+、NO3-、Na+10.近几年一种新型的甜味剂——木糖醇悄悄的走进人们的生活,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者等优点。木糖醇是一种白色粉末状的固体,结构简式为:CH2OH(CHOH)3CH2OH。下列有关木糖醇的叙述错误的是:A.木糖醇与葡萄糖、果糖等一样是一种单糖B.木糖醇极易溶于水C.木糖醇是一种五元醇D.木糖醇是一种无糖型植物甜味剂11、A、B、C、D、E五种主族元素原子序数逐渐增大,且均不超过18,其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是A.A与E形成的化合物为离子化合物B.气态氢化物的稳定性:B<EC.简单离子半径:E<DD.最高价氧化物对应水化物的碱性:C>D12、常温下,向10mL0.1mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是()A.pH=7时,所加醋酸溶液的体积为10mLB.pH7时,溶液中:c(CH3COO-)c(Na+)C.7pH13时,溶液中:c(Na+)c(CH3COO-)c(OH-)c(H+)D.继续滴加0.1mol·L-1醋酸溶液,溶液pH可以变为123.(16分)已知X、Y、Z、W、N是短周期中原子序数依次增大的五种主簇元素,通常情况下Y形成的单质为固体,其余的为气体。N是第三周期中阴离子半径最小的元素。Y元素能形成多种不同晶体类型的单质,其中的一种单质在电化学中常用做电极材料。W形成的一种单质具有强氧化性,可做漂白剂和消毒剂。根据上述信息回答下列问题。(1)X元素是,Z元素是。(用元素符号表示)(2)XYZ形成的晶体为分子晶体,写出其结构式;NaYZ的水溶液呈碱性,原因是(用离子方程式表示)。(3)X2W2是一种绿色氧化剂,写出其与酸性淀粉KI溶液反应的离子方程式。(4)某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质①利用Ⅰ、Ⅱ装置制取气体(K2关闭、K1打开),甲同学认为:利用Ⅱ装置可以收集X2等气体,但不能收集W2、ZW2或ZW气体,其理由是。②乙同学认为:利用Ⅱ装置作简单改进(但不改变瓶口朝向),也可以收集W2、ZW等气体,但不能收集ZW2气体,其改进的方法是。③丙同学想利用上述装置设计实验确认H2SO4、H2CO3和H2SiO3的酸性强弱。(不必再选用其它酸性溶液,且通过一次实验就可以达到目的)实验时,K1关闭、K2打开。锥形瓶内装固体,装置C(试管)中所盛的试剂是;出现的现象是。24.(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。②该反应的平衡常数表达式为__________________,升高温度,K值(填“增大”、“减小”或“不变”)。③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。A.升高温度B.充入He(g),使体系压强增大C.将H2O(g)从体系中分离D.再充入1molCO2和3molH2⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O则阴极反应式为:________________________________。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________。25.(15分)已知A为蓝色溶液,B、C、E、F为单质,其余均为化合物,其中B、L、F常温下为气体,且F为有色气体,C、E为金属,K的水溶液为黄色。各物质转化关系如图。回答下列问题:(1)反应②的化学方程式:_____________;(2)反应①的离子方程式:___________________;(3)用惰性电极电解400.00mLA溶液,一段时间内测得溶液pH=1,则需要向溶液中加入__________,其质量为____g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。(4)pH均为4的A溶液和D溶液中,由水电离出的c(H+)之是。(5)K和A的阳离子对H2O2分解的催化作用,为比较K和A对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:c(mol/L)0.751.000.500.2503100t(min)CO2CH3OHH2O②定性分析:如图甲可通过观察气泡产生的快慢可经定性比较得出结论。有同学提出该实验不太合理,其理由是,定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为,实验中需要测量的数据是。30、[化学——物质结构与性质](13分)Al和Si,Ge和As在周期表处于金属元素和非金属元素的过渡区域,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:(1)写出As在周期表中的位置,其价电子的电子排布式为;(2)Ge与As,哪种元素的第一电离能大?原因是;(3)AlCl3是化工生产中常用的催化剂,熔点为192.6℃,熔融状态是通过配位键形成二聚体Al2Cl6请画出Al2Cl6结构图示;(4)超高导热绝缘材料纳密氮化铝(AlN)在绝缘材料中应用广泛,其晶体结构与金刚石类似。则每个Al原子与个N原子相连,与同一个Al原子相连的N原子构成的空间构型为。氮化铝(AlN)与金刚砂(SiN)相比,晶体溶沸点较高的是,原因是。(5)液态SiCl4常用作烟雾剂,原因是Si的3d空轨道能与水配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其发烟原理。31.[化学——有机化学基础](13分)分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。试回答下列问题:(1)若A物质与H2发生加成反应,产物的名称为;C物质中含有的官能团名称是;(2)合成路线中反应③所属反应类型名称为;(3)反应④的化学方程式为;(4)反应⑥的化学方程式为;(5)满足以下要求的E的同分异构体有种,(要求:①属于芳香族化合物。②遇浓溴水能产生白色沉淀。)写出其中的一种的结构简式。KA
 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:高三化学试题(二)
链接地址:https://www.777doc.com/doc-1934073 .html