当前位置:首页 > 临时分类 > (包头专版)2018年中考化学复习方案 第7课时 自然界的水和常见溶液课件
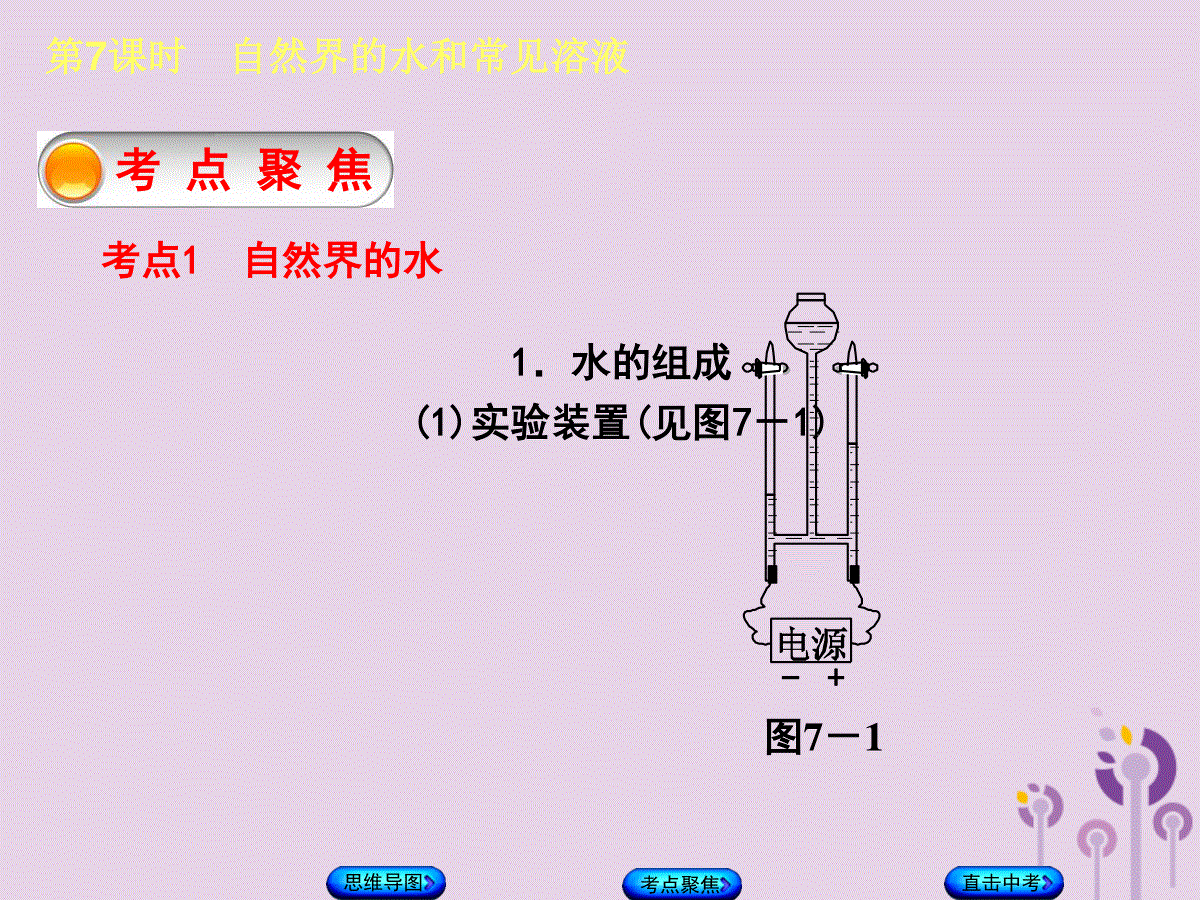
第7课时自然界的水和常见溶液第7课时自然界的水和常见溶液直击中考考点聚焦│考试说明│1.了解水的组成及水对人类生活的重要作用。2.知道纯水与矿泉水、硬水与软水的区别。3.了解吸附、沉淀、过滤和蒸馏等净化水的常用方法。4.认识溶解现象、结晶现象。5.认识饱和溶液的含义,认识溶解度的含义。6.知道水是重要溶剂,酒精、汽油也是常用溶剂。思维导图第7课时自然界的水和常见溶液直击中考考点聚焦思维导图思维导图第7课时自然界的水和常见溶液考点聚焦直击中考考点聚焦考点1自然界的水1.水的组成(1)实验装置(见图7-1)图7-1思维导图直击中考考点聚焦(2)实验现象:电极上有气泡产生,一段时间后,连接电源正极和负极的玻璃管中收集的气体体积比约为1∶2。(3)气体检验:用小试管收集一些气体,用带火星的木条检验正极产生的气体,发现它能使带火星的木条________,证明是________;将负极产生的气体移近火焰,气体能________,火焰呈淡蓝色,证明是________。(4)实验结论①水在通电条件下生成氢气和氧气。②水是由氢、氧两种元素组成的。③每个水分子是由2个氢原子和1个氧原子构成的。④本实验同时验证了在化学变化中,分子可以分成原子,而原子不能再分。第7课时自然界的水和常见溶液复燃氧气燃烧氢气思维导图直击中考考点聚焦【注意】①有时在电解水时,在水中加入少量稀硫酸或稀氢氧化钠溶液,是为了增强水的导电性,但它们并未参加反应。②在电解水的实验中,测得氢气和氧气的体积比往往不是2∶1,实际收集到氧气的体积比理论上应得到的小。可能的原因是:a.氧气在水中的溶解度比氢气的大;b.氧气在电极上发生了化学反应,部分被消耗了。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦2.水的净化(1)沉淀①静置沉淀:通过不溶性杂质自身的重力使它们从液体中沉降下来,净化程度相对较低。②吸附沉淀:利用某物质(如________)溶于水后生成的胶状物对杂质的吸附,使杂质沉降下来。(2)过滤:把不溶于液体的________与________分离的一种方法,它适用于分离固-液型的混合物。(3)吸附:常用________除去有臭味的物质和一些可溶性杂质。第7课时自然界的水和常见溶液明矾固体液体活性炭思维导图直击中考考点聚焦(4)蒸馏:除去水中可溶性杂质的方法,得到的蒸馏水可以看成是纯净物,净化程度相对较高。(5)过滤的基本操作实验器材:带铁圈的铁架台、漏斗、玻璃棒、烧杯(见图7-2)。第7课时自然界的水和常见溶液图7-2思维导图直击中考考点聚焦操作要领:“一贴、二低、三靠”。“一贴”:____________________,用少量水润湿滤纸并使滤纸与漏斗壁之间没有气泡。“二低”:_________________________、____________________________。“三靠”:_____________________________________、________________________________________________、________________________________________________。第7课时自然界的水和常见溶液滤纸紧贴漏斗内壁滤纸低于漏斗边缘待滤液液面低于滤纸边缘盛待过滤液的烧杯口紧靠玻璃棒玻璃棒下端轻靠三层滤纸的一边漏斗下端管口紧靠烧杯内壁思维导图直击中考考点聚焦【注意】①过滤时先过滤上层清液,后过滤下层浊液。若先过滤下层浊液,滤纸上将会残留着大量不溶性杂质,再过滤上层清液时,不溶物会阻碍清液的通过,影响过滤速率。②如果两次过滤之后滤液仍然浑浊,原因可能是滤纸破损或过滤时液面高于滤纸边缘等。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦3.硬水和软水(1)概念:硬水是含有较多___________________________的水;软水是不含或少含____________________________的水。(2)检验硬水和软水的方法加________,产生的泡沫______,有白色垢状物产生的是硬水;产生泡沫______的是软水。第7课时自然界的水和常见溶液可溶性钙、镁化合物可溶性钙、镁化合物肥皂水少多思维导图直击中考考点聚焦(3)硬水带来的危害①洗衣服时既浪费肥皂,还会使衣服变硬;②硬水会使锅炉内结垢,不仅浪费燃料,而且会使锅炉管道因局部过热,引起管道变形、损坏、爆炸。(4)硬水的软化方法在生活中可用煮沸的方法;实验室中常用蒸馏法或离子交换法。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦考点2溶液第7课时自然界的水和常见溶液1.概念:指______________物质分散到_________________物质里,形成的均一、稳定的混合物。2.特征:均一性、稳定性。均一性是指溶液中任意一部分的组成和性质完全相同。稳定性是指外界条件不变时(温度、溶剂量、压强等),溶质不会从溶剂中分离出来。一种或几种另一种思维导图直击中考考点聚焦【注意】①均一、稳定的液体并不一定是溶液。如水、酒精等。②溶液不一定都是无色的。如硫酸铜溶液呈蓝色,氯化铁溶液呈黄色等。3.组成:由__________、__________组成。被溶解的物质叫____________,能溶解其他物质的物质叫________。第7课时自然界的水和常见溶液溶质溶剂溶质溶剂思维导图直击中考考点聚焦4.溶质和溶剂的判断第7课时自然界的水和常见溶液溶液类型气液型固液型液液型无水有水溶质气体固体量少非水物质溶剂液体液体量多水思维导图直击中考考点聚焦【注意】①溶液通常根据溶质名称来命名,若溶剂不是水,还需指出溶剂的名称。如氯化钠溶液、蔗糖溶液、碘的酒精溶液(简称碘酒)等。②溶液中未溶解的部分不能视为溶质。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦5.分类:饱和溶液与不饱和溶液(1)概念:在一定温度下,向一定量溶剂里加入某种溶质,当______________________时,所得到的溶液叫作这种溶质的饱和溶液;______________的溶液,叫作这种溶质的不饱和溶液。(2)判断方法①当溶液中有固态溶质时,若固体____________,那么该溶液是饱和的;若固体________,那么该溶液是不饱和的。第7课时自然界的水和常见溶液溶质不能继续溶解还能继续溶解不再减少减少思维导图直击中考考点聚焦第7课时自然界的水和常见溶液②当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若溶质____________,则原溶液是饱和的;若溶质______________,则原溶液是不饱和的。③当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。(3)相互转化(一般情况)不再溶解继续溶解思维导图直击中考考点聚焦【注意】①某物质的饱和溶液是对相应的溶质不能继续溶解的溶液,但还可以溶解其他物质。如某饱和食盐水中还可以继续溶解硝酸钾固体。②通过降低温度实现由不饱和溶液向饱和溶液的转化,只是针对多数固体溶质而言的,对于溶解度随温度升高而减小的物质(如气体、熟石灰等)是不可行的。③对某饱和溶液进行降温或蒸发溶剂,往往会有溶质从溶液中以晶体形式析出。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦6.溶液的应用(1)在溶液中进行化学反应,可使反应速率变__________。(2)动植物对养料的运输、吸收只有在______的环境中才能进行。(3)医疗上常将一些药品配成溶液以方便使用。(4)利用物质溶解时的吸放热现象,可对物质进行鉴别。(5)利用物质溶解后溶液的沸点升高、凝固点降低,可清除公路上的冰雪等。7.乳化作用当在植物油中加入洗涤剂后,植物油就被分散成无数细小的液滴,而不能聚集成大的油珠,这种现象被称为__________。肥皂、洗发水等都具有乳化作用。第7课时自然界的水和常见溶液快溶液乳化思维导图直击中考考点聚焦8.溶解的现象(1)物质溶解时通常伴随有吸、放热现象。物质在溶解时,会同时发生以下两个过程:扩散过程(又称吸热过程):指溶质的分子或离子在水中扩散;水合过程(又称放热过程):指溶质的分子或离子与水分子作用形成水合分子或水合离子。(2)物质溶解时溶液温度的变化,取决于这两个过程中热量的相对大小。当吸热多于放热时,溶液温度降低,如________溶于水;当吸热少于放热时,溶液温度升高,如__________溶于水;当吸热等于放热时,溶液温度不变,如__________溶于水。第7课时自然界的水和常见溶液硝酸铵氢氧化钠氯化钠思维导图直击中考考点聚焦考点3溶解度第7课时自然界的水和常见溶液1.固体物质的溶解度(1)概念:在________下,某固态物质在______g溶剂里达到________状态时所溶解的________,叫作这种物质在这种溶剂里的溶解度。如果不指明溶剂,通常所说的溶解度是物质在水中的溶解度。(2)影响因素:①内因是溶质和溶剂的性质;②外因主要是________。一定温度100饱和质量温度思维导图直击中考考点聚焦【注意】①溶液的质量等于溶质质量与溶剂质量之和,但溶液的体积不一定等于溶质体积与溶剂体积之和。②物质溶解度的大小与溶质质量、溶剂质量的多少无关,在一定温度下,某物质的溶解度是一个定值。③判断某一数值是不是溶解度,关键是看它是否同时满足四个条件“一定温度、100g溶剂、饱和状态、溶解的溶质质量(单位:g)”。第7课时自然界的水和常见溶液④只有在饱和溶液中才存在如下关系:溶解度溶解度+100g=溶质质量溶液质量;溶解度100g=溶质质量溶剂质量思维导图直击中考考点聚焦(3)溶解度与溶解性的关系(20℃)第7课时自然界的水和常见溶液溶解度/g0.010.01~11~1010溶解性难溶微溶可溶易溶2.气体的溶解度(1)概念:是指在一定温度下,压强为________时,某气体溶解在______体积的水中达到________状态时的气体________。(2)影响因素:①内因是气体的性质;②外因主要是温度和压强。温度越高,气体的溶解度__________;压强越大,气体的溶解度________。101kPa1饱和体积越小越大思维导图直击中考考点聚焦3.溶解度曲线(1)概念:指溶解度随温度变化的曲线。横坐标表示________,纵坐标表示__________。(2)含义:①曲线上的点,表示某物质的饱和溶液;②曲线的走向表示某物质的溶解度随温度的变化情况;③两条溶解度曲线的交点表示________________________________。(3)应用①查找某一温度下物质的溶解度。②比较某一温度下两种物质溶解度的大小。第7课时自然界的水和常见溶液温度溶解度两种物质在某一温度下的溶解度相同思维导图直击中考考点聚焦③选择使某种物质从溶液中结晶的方法有蒸发溶剂法或冷却热饱和溶液法。4.结晶现象(1)晶体和结晶①晶体:具有熔点或凝固点的固体叫晶体。②结晶:形成晶体的过程叫结晶。(2)结晶的方法①蒸发结晶:用蒸发溶剂的方法使溶质结晶析出称为蒸发结晶。如从氯化钠溶液中提取氯化钠晶体,可采用蒸发结晶的方法。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦②降温结晶:用冷却热饱和溶液的方法使溶质结晶析出称为降温结晶。如从硝酸钾溶液中提取硝酸钾晶体,可采用降温结晶的方法。降温结晶的方法适合像硝酸钾这样的溶解度随温度升高而明显增大的物质,从其饱和溶液中提取溶质固体。第7课时自然界的水和常见溶液思维导图直击中考考点聚焦考点4溶液浓稀的表示法——溶质质量分数第7课时自然界的水和常见溶液1.关于溶质质量分数的计算溶质质量分数是________质量与________质量之比。有关公式:(1)溶质质量分数=溶质质量溶液质量×100%(既适用于饱和溶液的计算,也适用于不饱和溶液的计算)。(2)溶液质量=________质量+______质量。(3)溶质质量=________质量×溶质的质量分数;溶液质量=溶液的体积×溶液的密度。(4)饱和溶液中溶质的质量分数=S100g+S×100%(S表示对应温度下该溶质的溶解度),由此




 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:(包头专版)2018年中考化学复习方案 第7课时 自然界的水和常见溶液课件
链接地址:https://www.777doc.com/doc-8350007 .html