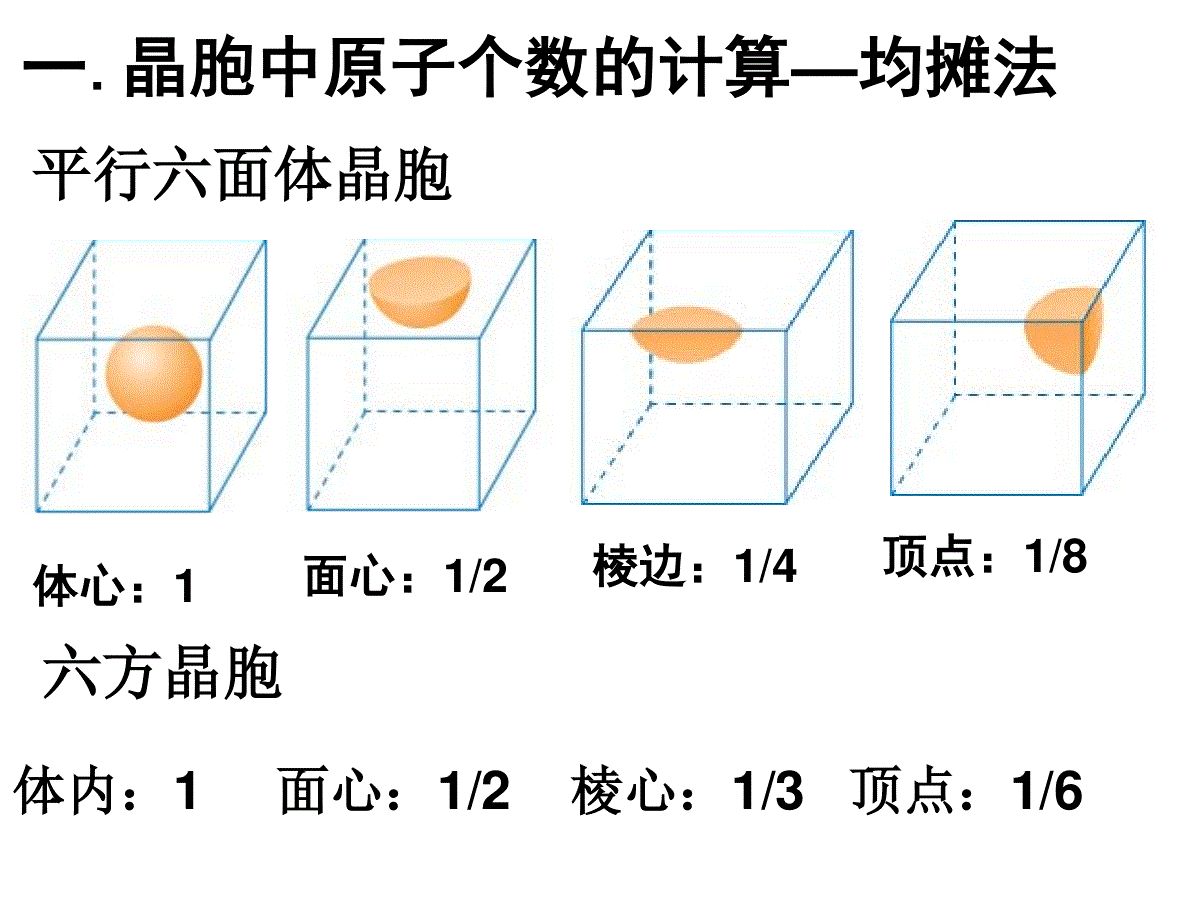
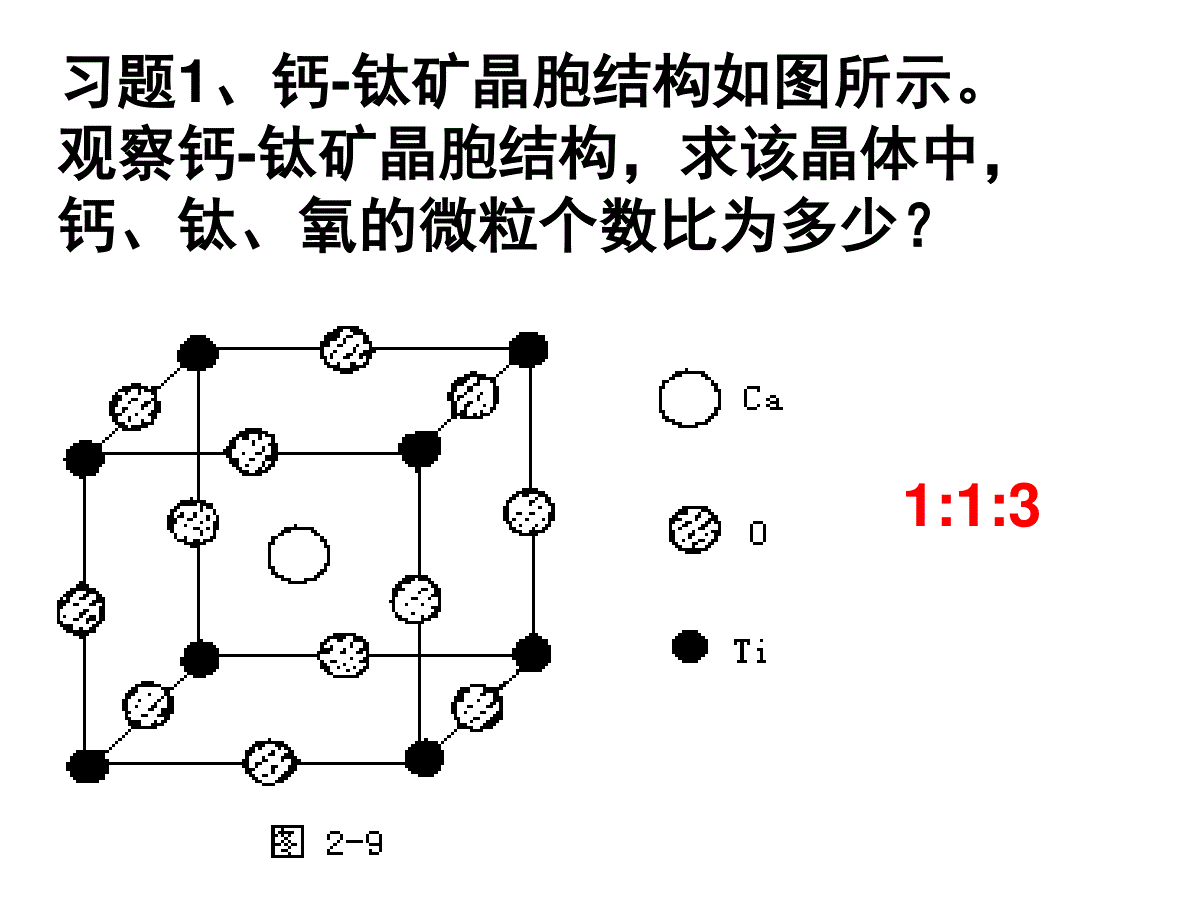
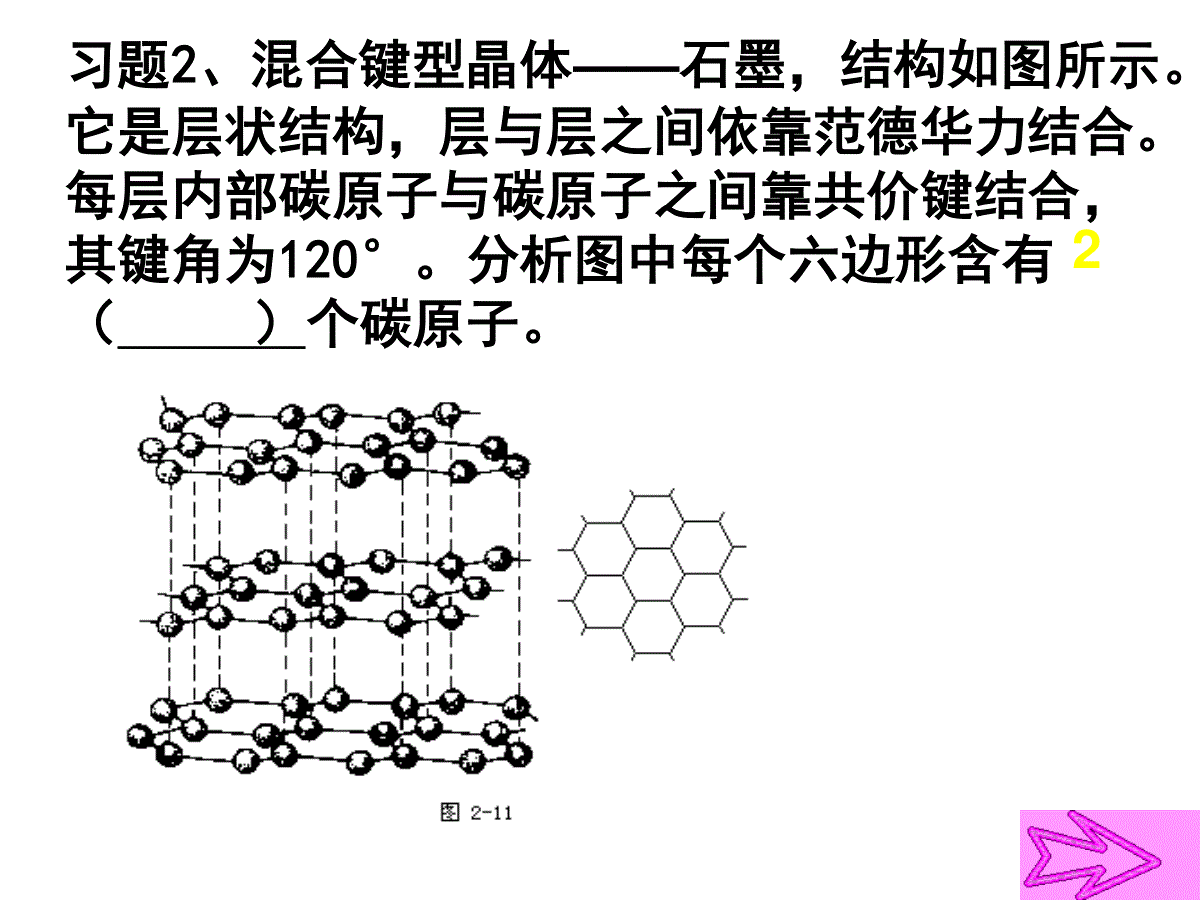
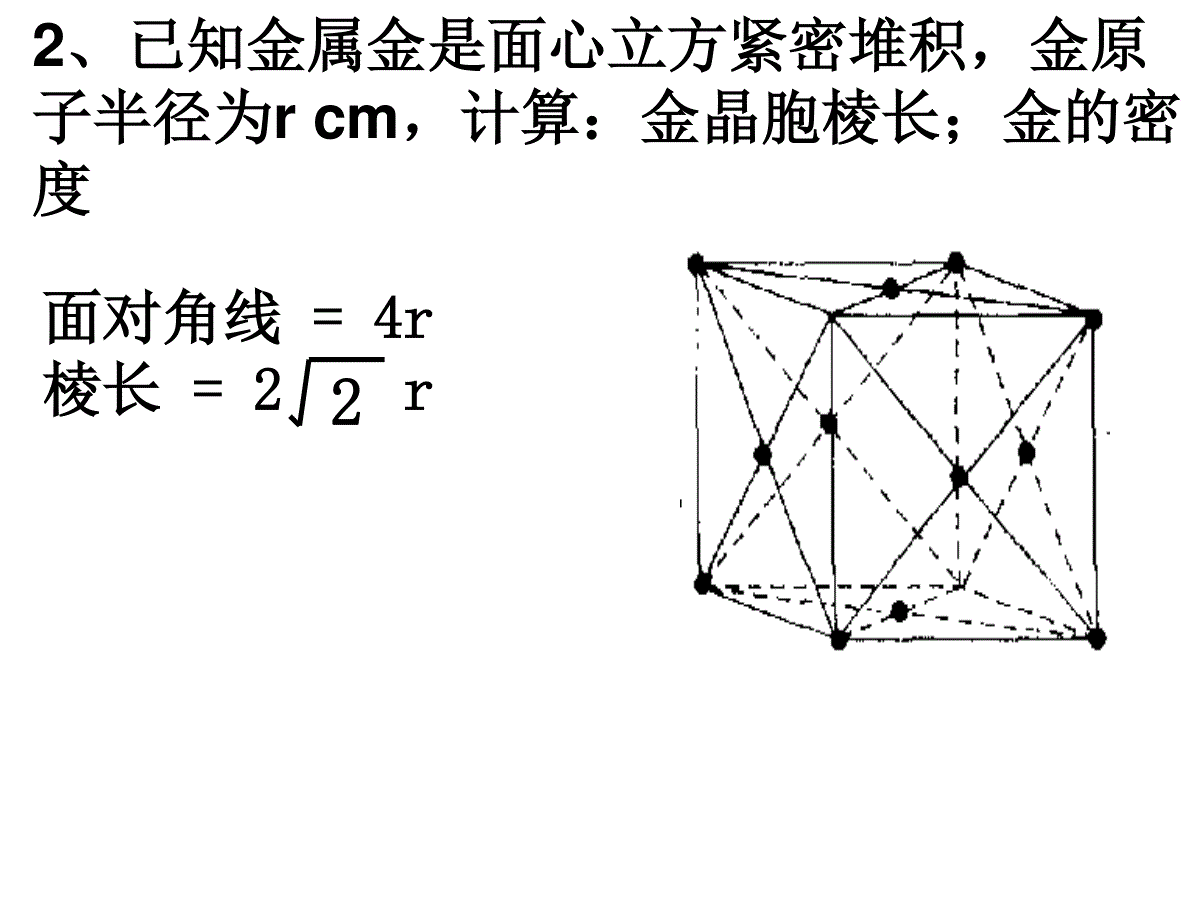
体心:1面心:1/2顶点:1/8棱边:1/4一.晶胞中原子个数的计算—均摊法平行六面体晶胞六方晶胞体内:1面心:1/2棱心:1/3顶点:1/6习题1、钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?1:1:3习题2、混合键型晶体——石墨,结构如图所示。它是层状结构,层与层之间依靠范德华力结合。每层内部碳原子与碳原子之间靠共价键结合,其键角为120°。分析图中每个六边形含有()个碳原子。21、已知:晶体中Na+和Cl-间最小距离为acm,计算NaCl晶体的密度3331125.29)(2a5.584cmgNacmmolNmolgAA二、晶胞密度的求算2、已知金属金是面心立方紧密堆积,金原子半径为rcm,计算:金晶胞棱长;金的密度面对角线=4r棱长=2r23、已知金属钾是体心立方紧密堆积,钾原子半径为rcm,请计算:钾晶胞棱长;钾的密度3棱长=4r/3体对角线=4r4、若已知下列各晶胞的棱长,你能求出下列数据吗?(1)氯化钠晶胞中,钠离子和氯离子最小间距(2)氯离子和氯离子的最小间距(3)氯化铯晶胞中,铯离子和氯离子的最小间距(4)硫化锌晶胞中,硫离子和锌离子的最小间距(5)金刚石晶胞中碳碳键键长三、晶胞中空间利用率的计算(1)简单立方:空间利用率:(2r)34лr3/3=52.36%微粒数为:8×1/8=1空间利用率=(微粒数*1个微粒体积)/晶胞体积空间利用率:4лr3/3空间利用率:4лr3/3(2r)3空间利用率:4лr3/3(2)体心立方:微粒数为:8×1/8+1=2(2根号2r)3空间利用率:2*4лr3/3(4)面心立方:微粒数:8×1/8+6×1/2=4空间利用率:(2×1.414r)34×4лr3/3=74.05%
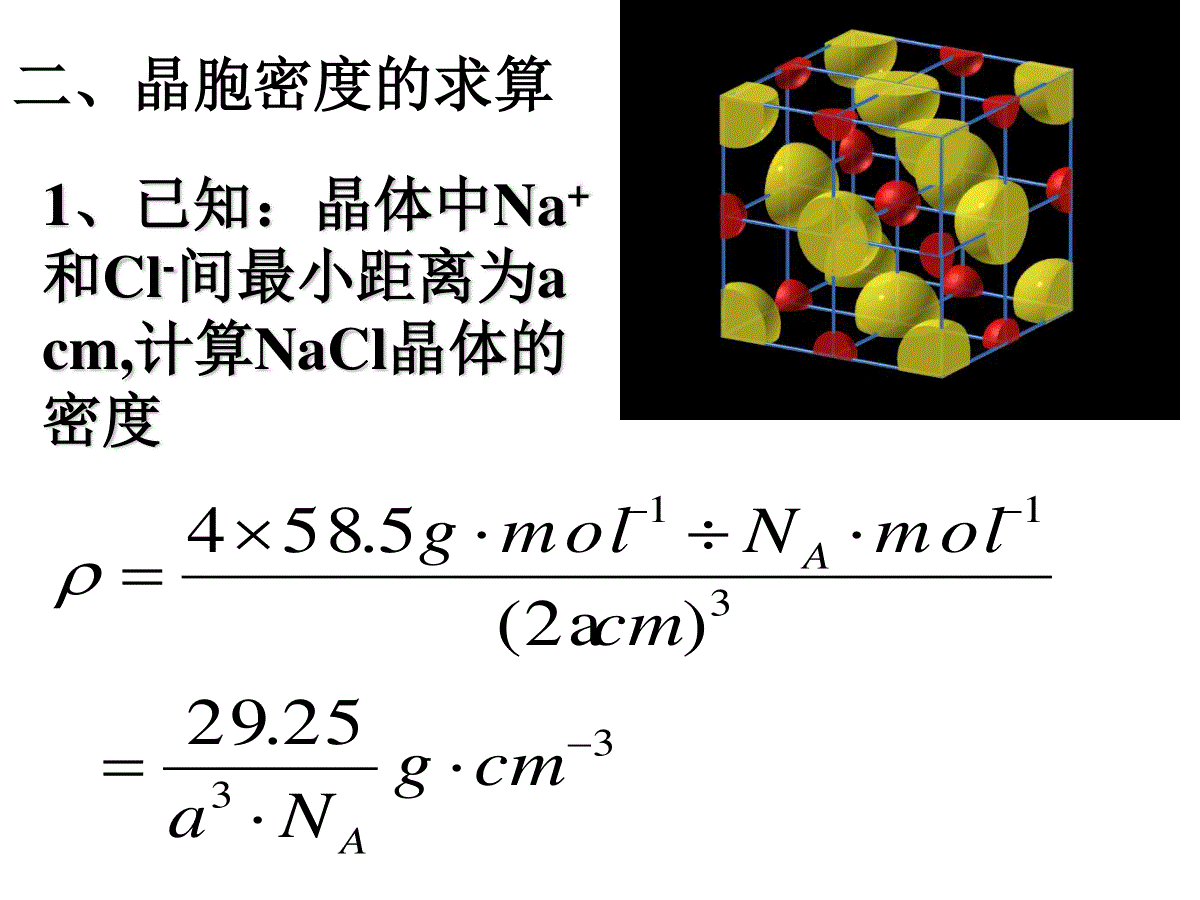
 三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
三七文档所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
本文标题:晶胞计算专题
链接地址:https://www.777doc.com/doc-7055439 .html